康方生物依沃西单抗(PD-1/VEGF)的临床研究,一项全球III期研究总生存期(OS)未达到统计学显著差异
5月30日,美国生物技术公司Summit Therapeutics(SMMT.US)公布了依沃西单抗全球Ⅲ期临床试验HARMONi研究的顶线结果。结果显示,相比单纯化疗,依沃西单抗联合化疗在PFS这一主要终点上取得统计学显著且具临床意义的改善,但在总生存期(OS)方面未达到统计学显著差异。受此消息影响,康方生物(HK.09926)今日港股大跌10.50%,收于75港元。
出海,50亿美元
依沃西单抗为康方生物(HK.09926)研发的一款PD-1/VEGF双抗,2022年12月6日,康方生物宣布与Summit Therapeutics达成合作协议,后者获得康方生物PD-1/VEGF双抗AK112在美国、加拿大、欧洲、加拿大和日本的权益,Summit支付5亿美元预付款,以及最高50亿美元的总交易金额,包括开发、注册、商业化里程碑金额。该笔交易的达成促使行业和市场大幅聚焦康方生物和PD-1/VEGF双抗药物研发。康方生物的股价也由2022年12月6日的31.15港元在震荡上行至目前的75港元,总市值超过650亿港元。
2024年6月3日,康方生物与Summit Therapeutics签署了补充许可协议,在双方原有关于PD-1/VEGF双特异性抗体依沃西的合作许可协议下,拓展依沃西的许可市场范围。Summit将新增获得依沃西在中美、南美、中东和非洲等相关市场的开发及商业化独家权益。同时,Summit将继续负责包括新增许可市场在内的所有许可地区的临床开发、产品注册及商业化,及其所有相关费用。康方生物同时将获得7000万美元的首付款和里程碑款,以及依沃西在新增许可市场的销售提成,提成比例与2022年12月5日双方签订的合作协议的比例一致。康方生物将继续为包括新增许可市场在内的所有许可市场供应依沃西单抗注射液,并获得供货收入。同时,在补充许可协议中,双方进一步强化了包括临床试验数据、上市申报文件等成果的跨地区共享合作条款,以加速依沃西在全球各地区的监管注册及商业化。
目前依沃西单抗已获批两项适应症,2024年5月,国家药监局批准依沃西单抗(商品名:依达方)新药上市申请,适应症为依沃西联合化疗用于治疗EGFR-TKI治疗后进展的EGFR突变的局部晚期或转移性非鳞状非小细胞肺癌,2024年11月,依沃西该项适应症被成功纳入最新版国家医保药品目录,并于2025年1月1日起实施。2025 年 4 月 25 日,获批单药用于 PD - L1 肿瘤比例分数(TPS)≥1% 的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌一线单药治疗,而上述两项获批适应症的临床研究成果也普遍受到业内的关注。
依沃西单抗VS帕博利珠单抗(K药)
2024年5月,康方生物宣布依沃西成为全球首个且唯一在III期单药头对头临床研究中证明疗效显著优于帕博利珠单抗(K药)的药物。该临床试验(HARMONi-2/AK112-303)共入组398例受试者,患者群体为PD-L1阳性的非小细胞肺癌患者群体,包括低表达肺癌人群。其中PD-L1 TPS 1-49%占比为57.8%,PD-L1 TPS≥50%占比为42.2%,与真实世界患者表达水平分布一致;依沃西组在PD-L1 TPS 1-49%和PD-L1 TPS ≥50%的人群中,PFS(无进展生存期)获益均非常显著,并且各个亚组疗效分析均显示强阳性结果,包括鳞癌、非鳞癌,有/无肝转移、有/无脑转移等患者人群,达到无进展生存期(PFS)的主要研究终点。基于HARMONi-2研究结果,依沃西单抗该项适应症的新药上市申请(sNDA)于2024年7月29日获得CDE受理,并于2024年8月14日被纳入优先审评品种名单。2025年 4 月 25 日,获得国家药监局的批准上市,获批单药用于 PD - L1 肿瘤比例分数(TPS)≥1% 的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌一线单药治疗。根据进一步公开的临床数据,在ITT人群中,依沃西组和帕博利珠组的中位无进展生存期(PFS)分别为11.14个月和5.82个月,PFS HR=0.51(P<0.0001),依沃西治疗组的疾病进展/死亡风险降低49%;在ITT人群中,在39%成熟度时进行的总生存期(OS)的期中分析(本次分析α分配值仅为0.0001)结果显示,依沃西对比帕博利珠单抗具有显著的临床生存获益,HR=0.777,降低死亡风险22.3%;在上述数据中,针对质疑的总生存期(OS)效果,2025年4月28日康方生物召开的业务亮点沟通会上,康方生物表示:“给出OS数据的目的是因为药监局需要,但实际上AK112-303的试验终点并不是OS。”
针对EGFR-TKI治疗后进展的非小细胞肺癌研究
目前,EGFR-TKIs显著延长了具有EGFR突变的晚期非小细胞肺癌(NSCLC)患者的无进展生存期(PFS)。然而,EGFR-TKI治疗失败后,后续治疗往往显示出非常有限的临床疗效,抗PD-(L)1单药治疗在EGFR-TKI耐药后患者中并未显示出生存获益。针对该临床需求,康方生物开展了HARMONi-A/AK112-301的临床研究。
2024年6月,在ASCO大会现场以Oral报告的形式发布了依达方联合化疗用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC)的Ⅲ期临床研究(HARMONi-A)期中分析成果。本次数据分析(除OS)截至2023年3月,中位随访时间为7.89个月,ITT人群中ECOG评分1分占比约82%(264/322)。HARMONi-A研究意向治疗(ITT)人群中,既往接受3代TKI治疗人群占86%(276/322),更符合真实世界患者情况。研究结果显示,两组中位PFS分别为7.1个月vs 4.8个月(风险比,HR=0.46,95% CI: 0.34~0.62,P<0.001),降低疾病进展或死亡风险54%。康方生物当时称,一直以来,肿瘤免疫疗法针对这一适应症均未能取得很好的突破,此前包括帕博利珠单抗和纳武利尤单抗的相关研究均未能取得阳性结果,HARMONi-A研究优异结果展现了依沃西迭代PD-1抑制剂的巨大临床潜力。
基于HARMONi-A/AK112-301研究结果,2024年5月,国家药品监督管理局(NMPA)批准了依沃西单抗上市,用于联合化疗治疗经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC)。该疗法已被纳入《2024 CSCO非小细胞肺癌诊疗指南》和《IV期原发性肺癌中国治疗指南(2024)》。
2025年5月30日,Summit Therapeutics(SMMT.US)宣布了依沃西单抗全球Ⅲ期临床试验HARMONi研究结果。HARMONi试验旨在评估依沃西(ivonescimab)联合化疗与安慰剂联合化疗在局部晚期或转移性非鳞状非小细胞肺癌患者中的疗效,这些患者的肿瘤携带表皮生长因子受体(EGFR)突变。这类患者对第三代EGFR酪氨酸激酶抑制剂治疗无效。该研究纳入了约38%的欧美等国的患者,这一比例与其他近期针对EGFR突变NSCLC适应症的国际多中心III期研究相一致,与单纯化疗相比,依沃西与化疗联合的无进展生存期(PFS)风险比值(HR)为0.52(疾病进展或死亡风险降低48%),总生存期(OS)HR为0.79;结果显示,相比单纯化疗,依沃西单抗联合化疗在PFS这一主要终点上取得统计学显著且具临床意义的改善,但在总生存期(OS)方面未达到统计学显著差异,Summit Therapeutics表示,将基于HARMONi研究结果和FDA的沟通,推进依沃西单抗上市申请。针对上述数据,美股市场给予了负面反馈,5月30日,Summit股价下跌4.77%。
在康方生物5月30日发布的新闻消息中,康方生物称针对EGFR突变非小细胞肺癌二线及以上治疗(2L+ EGFRm NSCLC),迄今为止,美国食品药品监督管理局(FDA)批准上市的药物均没有获得OS的统计学显著性。(注:2024年9月,FDA基于MARIPOSA-2研究批准了EGFR/c-Met双抗治疗EGFR-TKI治疗进展的EGFR-19del或L858R突变的nsq-NSCLC)因此包括美国在内的其他国家市场中,2L+ EGFRm NSCLC治疗仍存在巨大的未满足的临床需求,获批的治疗方案十分有限。HARMONi研究结果进一步支持了其在二线及以上EGFR突变非小细胞肺癌(2L+ EGFRm NSCLC)中的应用。并称欧美亚组人群的中位随访时间短于分析时的mOS,研究的长期OS结果仍需继续随访。
依沃西单抗的其他临床研究
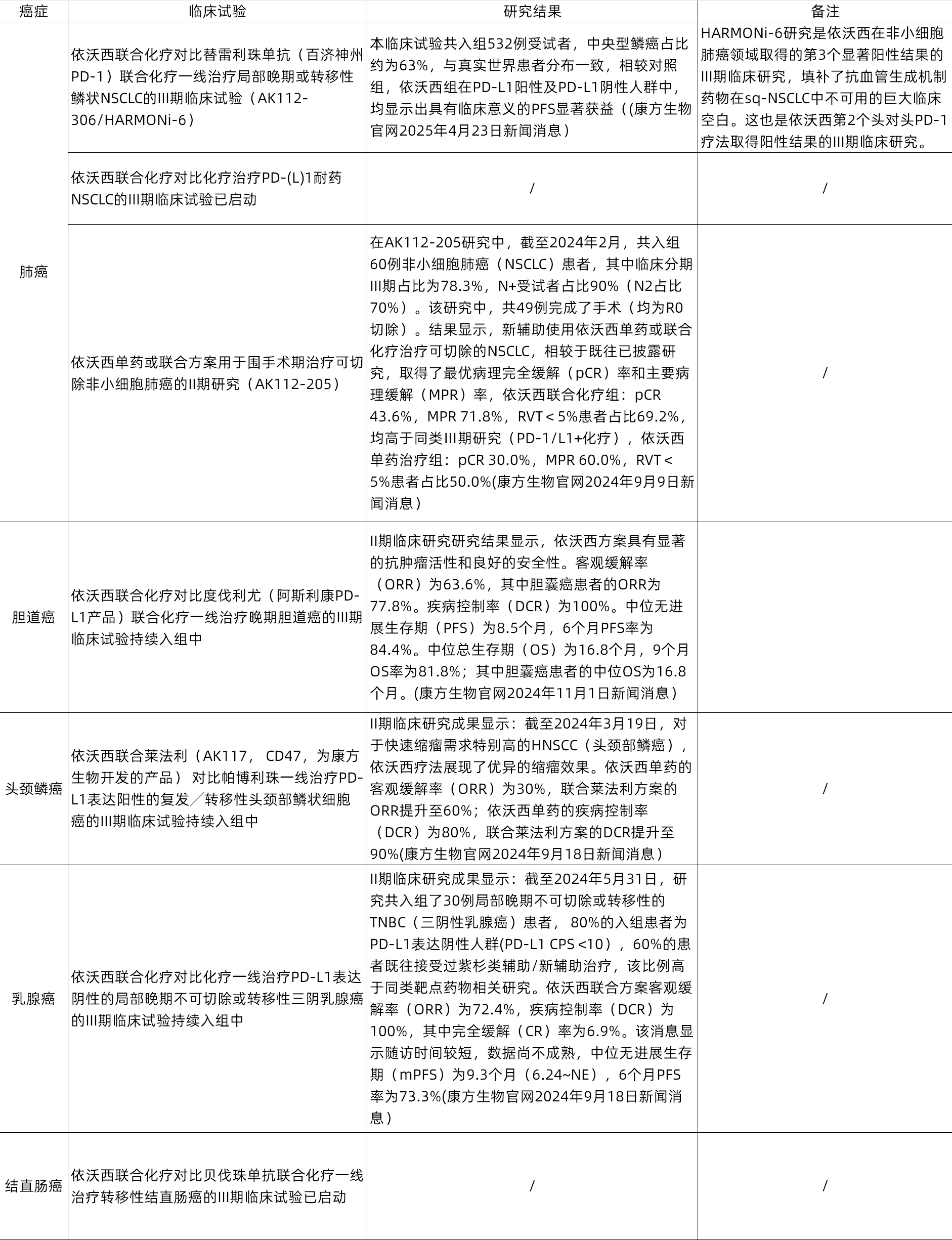
目前,依沃西单抗除进行上述研究外,还在进行多项适应症的开展。根据康方生物2024年年报和官网消息,依沃西单抗还在开展如下试验:
制表:药上市
康方生物管线图 来源:康方生物2024年年报
根据2024年年报,康方生物商业销售收入为人民币20.02亿元,2023年为16.03亿元,同比增长24.88%,增长主要归因于2024年5月获批的依沃西单抗。