盐酸溴己新注射液国家集采废标
8月21日,国家组织药品联合采购办公室正式通报盐酸溴己新注射液国家集采存在串标、围标行为的处罚通报。
经调查,成都欣捷高新技术开发股份有限公司(下称“成都欣捷”)、仁合益康集团有限公司(下称“仁合益康”)、广州一品红制药有限公司(下称“广州一品红”)、石家庄四药有限公司(下称“石家庄四药”)、上海旭东海普药业有限公司(下称“上海旭东海普”)、江西亿友药业有限公司(下称“江西亿友”)6家企业在第七批国家组织药品集中采购品种盐酸溴己新注射液投标中存在串通申报、协商报价行为,违背在申报材料中作出的承诺,违反《全国药品集中采购文件(GY-YD2022-1)》有关条款。根据批露消息,上述串标企业和代理商之间通过签订代理协议、协商申报价格、给予利益分成等方式,事先约定了中选企业和落选企业,涉嫌违反采购标书及有关法律规定,并造成医保基金损失。
经国家组织药品联合采购办公室各成员单位集体审议,决定取消成都欣捷、仁合益康、广州一品红、石家庄四药4家盐酸溴己新注射液原中选企业的中选资格,将上述4家企业及上海旭东海普、江西亿友2家非中选企业列入“违规名单”。
经前期约谈,成都欣捷、仁合益康、广州一品红、石家庄四药已退回医保资金损失,主动下调盐酸溴己新注射液价格,并另外选取3-4个药品主动降价。同时,鉴于仁合益康、广州一品红、石家庄四药3家企业在调查中积极配合并提供有价值的线索,决定暂停其从2024年8月21日至2025年2月20日(6个月)参与国家组织药品集中采购的资格;对成都欣捷、上海旭东海普、江西亿友3家企业,暂停从2024年8月21日至2025年8月20日(12个月)参与国家组织药品集中采购的资格。
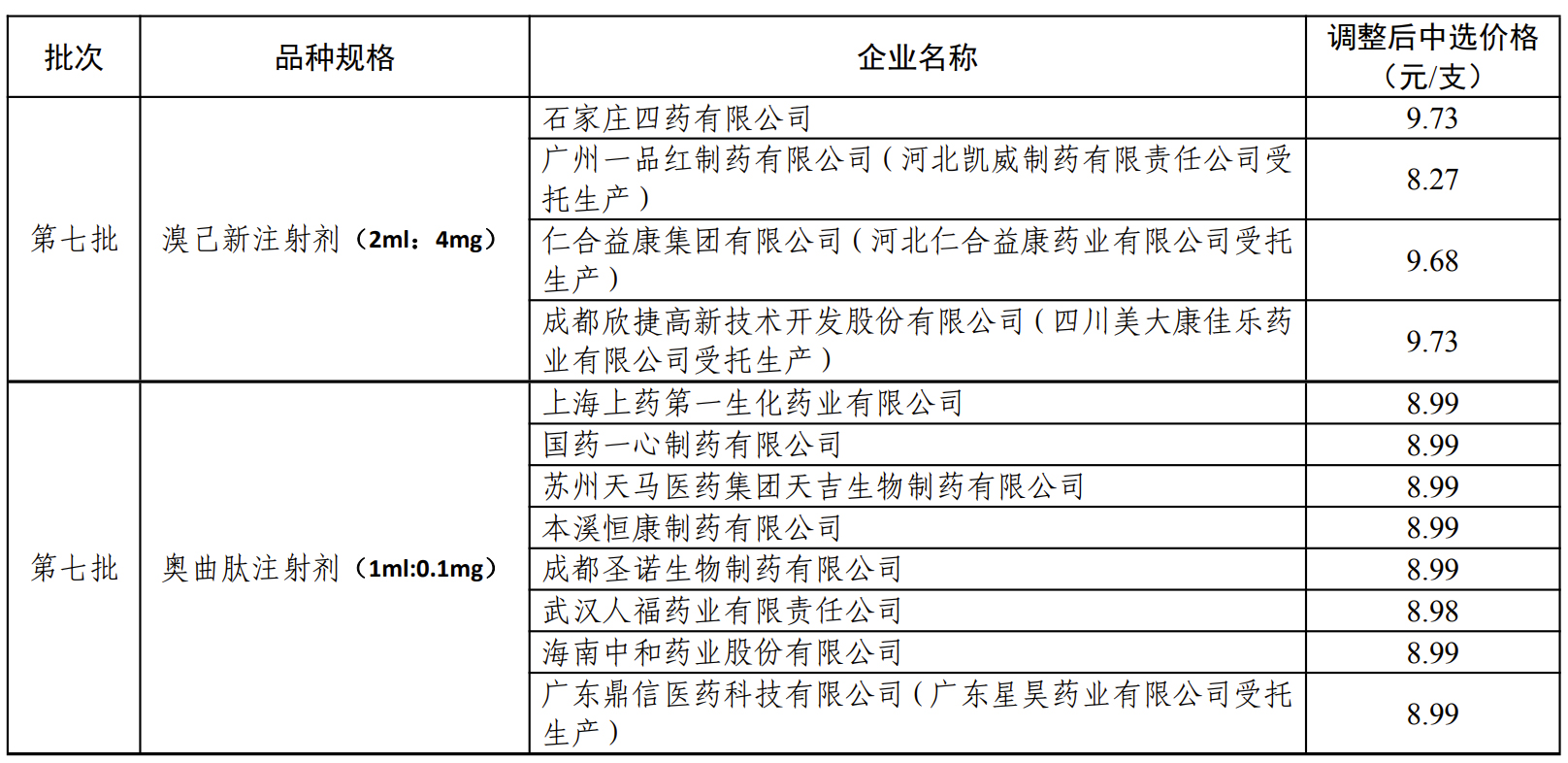
盐酸溴己新注射液此前下调后的中选价格
第七批国家组织药品集中采购品种盐酸溴己新注射液作废标处理,请各地按非集采品种进行挂网管理,确保临床供应。
同日,上海市医药集中招标采购事务管理所发布相关公告,将江西亿友、上海旭东海普、石家庄四药评定为严重失信。
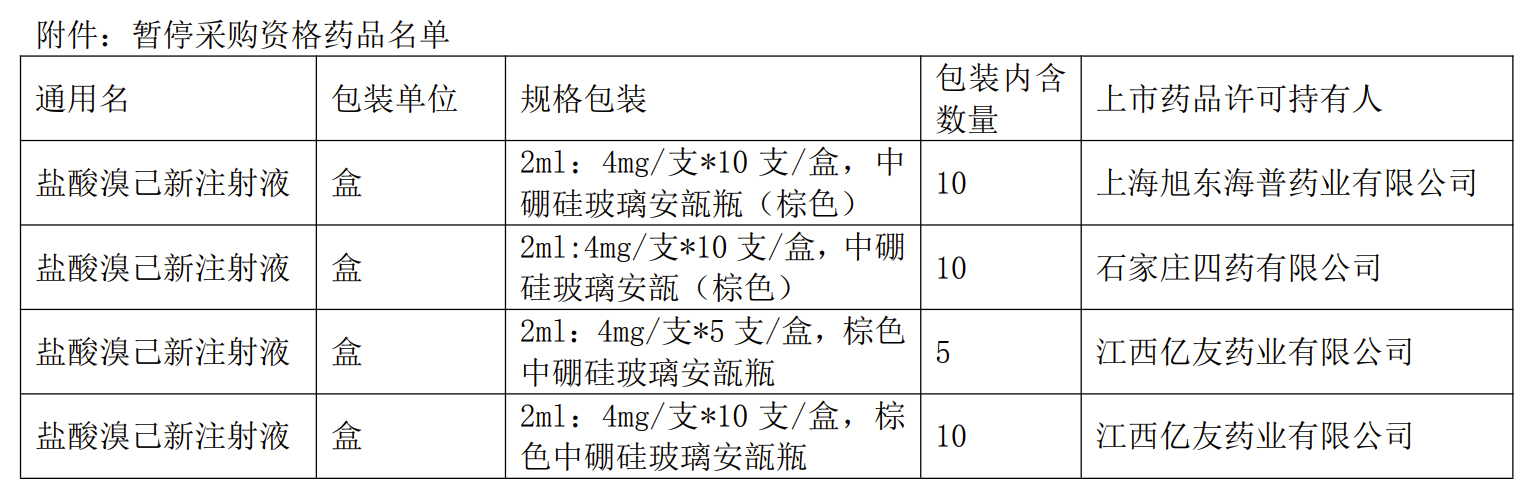
同时,上海市医药集中招标采购事务管理所发布《关于暂停部分溴己新注射液采购资格的通知》,根据部分溴己新注射液集采投标企业的失信评级结果,从2024年8月21日24时起暂停附件中所列溴己新注射液的采购资格,同时暂停医保结算。
此前,石家庄四药已发布公告,其在海南、河北和宁夏列为严重失信,并有可能在集采覆盖的福建、上海、江西、浙江、新疆及云南六个省市被列为严重失信。
一品红此前发布的公告显示,公司根据2022年至今盐酸溴己新注射液的销售数据测算,违约行为造成采购方损失2.66亿元。一品红将严格按照相关约定,全数退回损失金额。石家庄四药等其他企业则未披露退回金额数据。根据石四药2023年业绩公告,2023年其盐酸溴己新注射液销售3417万支,同比增长98%,如果按照第七批集采169.70元/盒(2ml:4mg*2ml/支,10支/盒 )计算,则石四药2023年盐酸溴己新注射液销售收入约为5.8亿元。
另值得注意的是,各有关部门已对串通投标团伙、6家企业及有关人员涉嫌违法犯罪问题开展调查。