科济药业3款CAR-T临床试验被暂停
近日,科济药业发布公告称,其在美国的子公司CARsgen Therapeutics Corporation收到FDA的通知,要求暂停CT053、CT041和CT071的临床试验,等待对位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。科济药业表示,将对现行药品生产质量管理规范(cGMP)进行全面检查和改进,并承诺与FDA密切合作,解决检查发现的问题,以确保临床试验和上市申请的顺利进行和高质量生产。
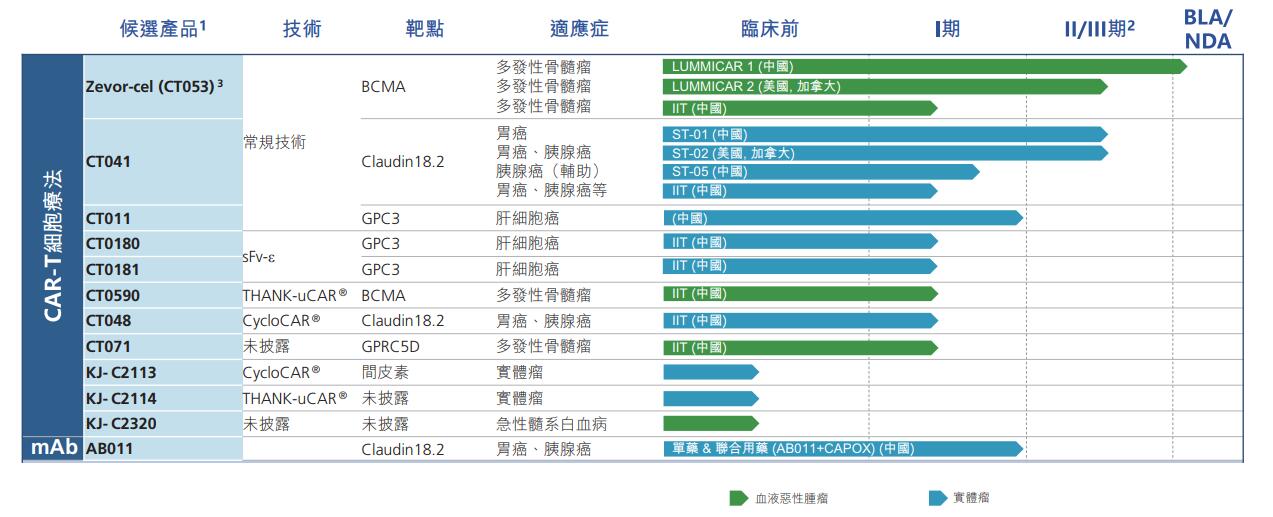
资料显示,科济药业成立于2014年,专注于治疗实体瘤和血液恶性肿瘤的创新嵌合抗原受体T细胞(CAR-T)疗法,2021年6月,科济药业在港交所敲钟上市,目前已有11款CAR-T细胞疗法在研,此次涉及的3款正是科济药业进展较快的几款。
CT053,即泽沃基奥仑赛注射液(Zevor-cel),是一种抗BCMA自体CAR-T细胞候选产品,用于治疗复发/难治多发性骨髓瘤(R/R MM),进展最快。在国内,2022年10月中国国家药品监督管理局已受理该疗法的新药上市申请(NDA),并将该申请纳入优先审评,预计泽沃基奥仑赛注射液将于2023年底或2024年初获国家药品监督管理局批准用于治疗R/R MM。同时,2023年1月科济药业和华东医药全资子公司华东医药(杭州)有限公司就泽沃基奥仑赛注射液签订合作协议,共同推动该疗法在中国的获批及商业化。在国外,科济药业正在美国及加拿大开展其用于治疗R/R MM的2期试验,并计划于2025年上半年向美国FDA提交BLA。
CT041,是一种靶向Claudin18.2蛋白的自体CAR-T细胞候选产品。在国内,CT041已于2023年4月获得国家药监局的IND批准用于Claudin18.2表达阳性的胰腺癌术后辅助治疗。科济药业计划于2024向中国国家药品监督管理局提交CT041用于治疗晚期胃癌(GC)的NDA。在国外,CT041已于2023年5月启动在美国的2期临床试验,用于治疗至少二线治疗失败的Claudin18.2表达阳性的晚期胃癌/食管胃结合部腺癌患者。2023年8月21日,科济药业宣布与Moderna已启动一项合作协议,以研究CT041与Moderna的Claudin18.2 mRNA癌症疫苗的组合效果。
CT071,是一种利用科济药业专有技术靶向G蛋白偶联受体C5家族亚型D(GPRC5D)的CAR-T细胞候选产品,用于治疗R/R MM。关于该疗法的一项研究者发起的临床试验已经在中国启动,评估CT071治疗R/R MM的安全性和疗效。
对于上述三款CAR-T产品临床试验被叫停一事,科济药业在公告中称,系因CMC(Chemical Manufacture and Control,化学成分生产和控制)相关问题,不过科济药业并未就所涉的CMC细节问题作进一步披露。据澎湃新闻的报道,科济药业表示,FDA本次并未针对公司临床数据提出疑问,此次FDA的专业建议主要是因CMC(化学、制造和控制)相关问题,有些员工培训等遗留问题需进行合规完善,并非针对工艺问题,这也让公司有了明确的观察项,帮助公司更有针对性地提升。公司有信心很快完成,会尽快将整改方案提供给FDA,后续保持交流,并落实整改。
据科济药业2023年半年报显示,该公司针对CAR-T制造的三个关键阶段已经建立了独立自主的内部垂直一体化的生产能力,包括质粒生产、慢病毒载体生产及CAR-T细胞生产,位于北卡罗来纳州达勒姆的生产工厂已经开始自体CAR-T细胞产品的GMP(药品生产质量管理规范)生产,支持在美国、加拿大及欧洲的临床研究和早期商业化。