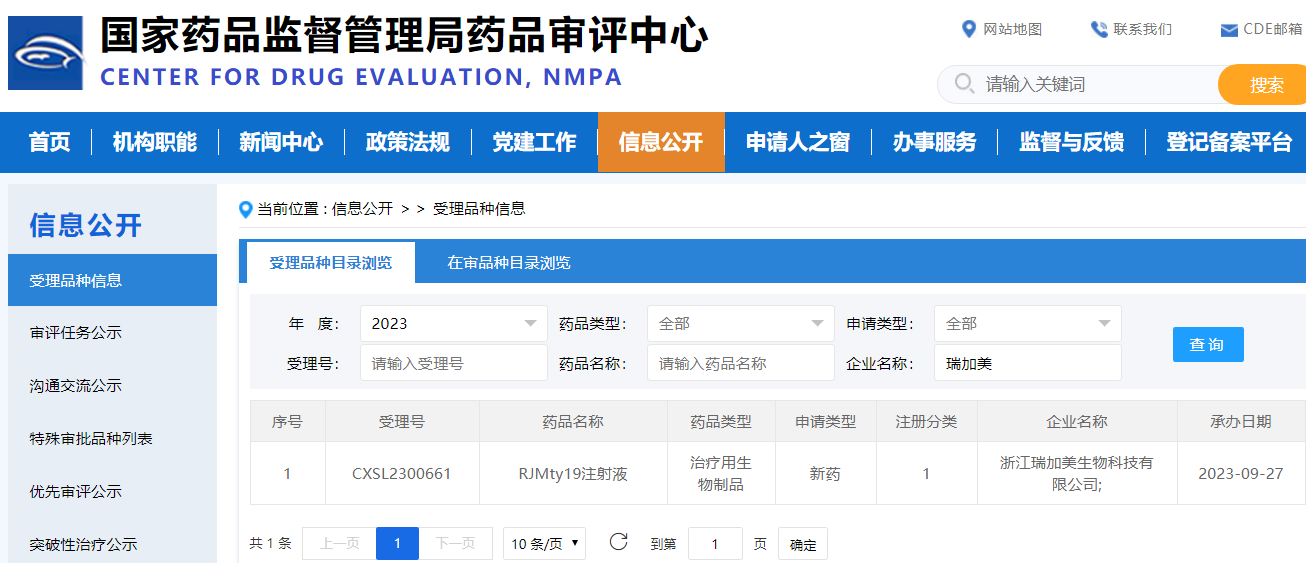
瑞顺生物通用型CD19-CAR-DNT细胞疗法IND申请获受理
近日,广东瑞顺生物技术有限公司(下称“瑞顺生物”)宣布,其全资子公司——浙江瑞加美生物科技有限公司递交的“RJMty19注射液治疗复发/难治性自身免疫性疾病”IND申请得到国家药品监督管理局(NMPA)药品审评中心(CDE)正式受理(受理号:CXSL2300661)。
自身免疫性疾病(Autoimmune Disease,AID),是指机体对自身抗原发生免疫反应导致自身组织损害所引起的疾病。AID会累及皮肤、关节、肾脏、中枢神经系统等多个人体器官系统,对人体健康造成极大的伤害,严重影响患者的生活质量和寿命。AID总体发病率占全球人口的5-9%,其中美国约5%-8%,中国约2-3%。
近年来,B细胞清除治疗被广泛应用于自身免疫性疾病的治疗。已有国内外临床研究报道证明,以CD19为靶点的自体CAR-T细胞(嵌合抗原受体T细胞)能特异性与B细胞表面的CD19抗原结合,通过抗体依赖或补体依赖的细胞毒作用清除B细胞,继而有效降低体内炎症介质水平,特异性发挥免疫抑制的治疗效果,有效治疗系统性红斑狼疮、系统性硬化症、特发性炎性肌病等自身免疫性疾病。
RJMty19注射液(主要活性成分为CD19-CAR-DNT细胞)是由瑞顺生物基于人源化CD19-CAR全球专利开发的一款全球创新现货通用型DNT细胞治疗产品。据悉,与目前已上市6款CD19-CAR-T细胞治疗产品相比,CD19-CAR-DNT细胞具有可实现标准化制备、制备成本低、患者即时可用等特点。
RJMty19注射液在浙江大学医学院附属第二医院血液科开展的研究者发起的临床研究显示,已有12名患者完成DLT评估(剂量限制性毒性),未观察到≥3级细胞因子释放综合征(CRS)、移植物抗宿主病(GvHD)、免疫效应细胞相关的神经毒性综合征(ICANS)、严重不良事件(SAE),临床安全性良好。在临床疗效方面,随着剂量增加,临床疗效提升。第4剂量组3例受试者在单次给药后全部获得临床缓解,客观缓解率(ORR)为100%(3/3),完全缓解率(CRR)为33.3%(1/3)。
资料显示,瑞顺生物专注于研发以DNT细胞为核心技术平台的现货通用型免疫细胞产品,目前已开发了多款基于DNT细胞技术平台的现货通用型细胞治疗产品,包括RC1012注射液、RJMty19注射液等,目前正在开展针对血液肿瘤的两个注册IND临床试验和两个研究者发起的临床试验。
2020年11月,RC1012关于“治疗复发难治性急性髓系白血病”适应症的临床试验申请获得CDE临床默示许可。RC1012注射液的主要成分为DNT细胞。DNT细胞又称双阴性T细胞,是正常人外周血中表达CD3分子,但不表达CD4和CD8分子的T细胞亚型,比NK细胞具有更强的特异性杀死AML肿瘤细胞的活性和更长的体内持续时间。今年1月,RC1012注射液新适应症临床试验申请得到中国国家药品监督管理局药品审评中心(CDE)正式批准,拟用于预防急性髓系白血病(AML)异基因造血干细胞移植后复发。