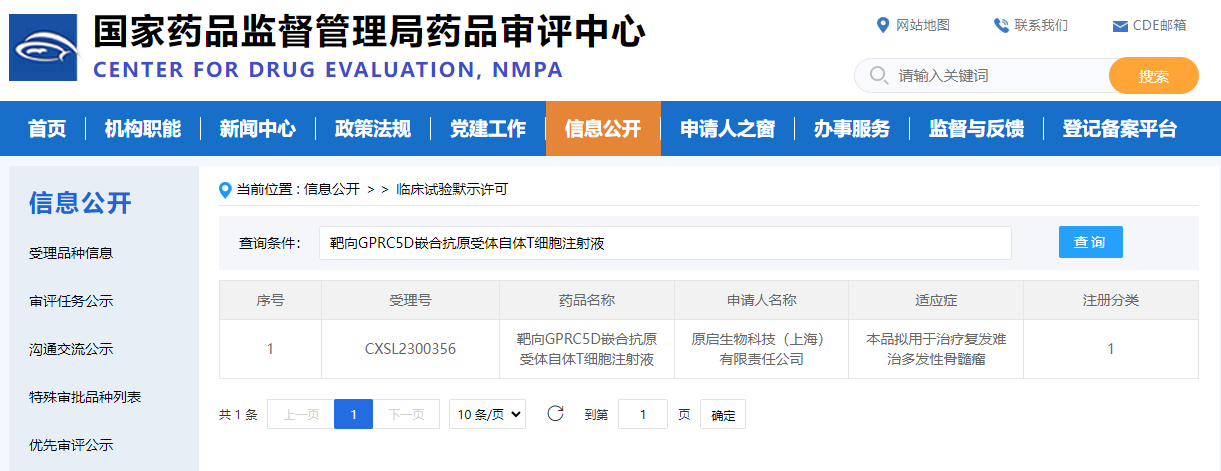
国内首个,原启生物靶向GPRC5D 的CAR-T疗法临床试验获批
日前,据国家药监局官网信息显示,原启生物靶向GPRC5D治疗R/R MM(复发难治性多发性骨髓瘤)的CAR-T产品OriCAR-017注射液新药临床试验(IND)申请获得正式批准,这也是中国首个、全球第二个获批临床的靶向GPRC5D的CAR-T细胞治疗产品。
据了解,GPRC5D是一种G蛋白偶联受体,在多发性骨髓瘤细胞上高度表达,而在正常组织中的表达较低,是多发性骨髓瘤一种有潜力的治疗靶点。研究发现,GPRC5D与BCMA彼此独立表达,因此无论是对于复发难治的末线患者,还是对于曾接受BCMA为靶点的CAR-T、双抗或ADC药物治疗后,BCMA低表达或阴性的复发病例,GPRC5D靶向药物都有望成为新的治疗选择,具有巨大的临床价值。
此前,OriCAR-017的探索性临床研究阶段数据已经在2022年ASCO(美国临床肿瘤学会年会)和2022年EHA(欧洲血液学会年会)上披露,该项研究入组10名患者,包含5名曾接受BCMA CAR-T细胞疗法治疗的病例,4名伴髓外病变(EMD)的病例。据最新数据显示,中位随访时间为280天(217~459天),ORR(总体缓解率)达到100%,sCR(严格意义的完全缓解)达到80%。安全性方面,经治疗后,患者仅出现1例2级CRS(细胞因子释放综合征),其余均为1级,未发现ICANS(免疫效应细胞相关神经毒性综合征),且没有出现3级及以上的皮肤毒性和指甲变化,且在接受治疗后的长期随访中未观察到感染事件发生。
去年10月,OriCAR-017被美国FDA授予孤儿药资格认定(ODD),该认定主要基于OriCAR-017产品在中国开展的first-in-human(FIH)I期临床研究的积极结果(NCT05016778)。在获得孤儿药资格后,OriCAR-017产品将有资格享受若干优惠政策,包括FDA对临床研究指导支持、特殊费用减免,以及批准上市后产品在美国的七年市场独占权等。
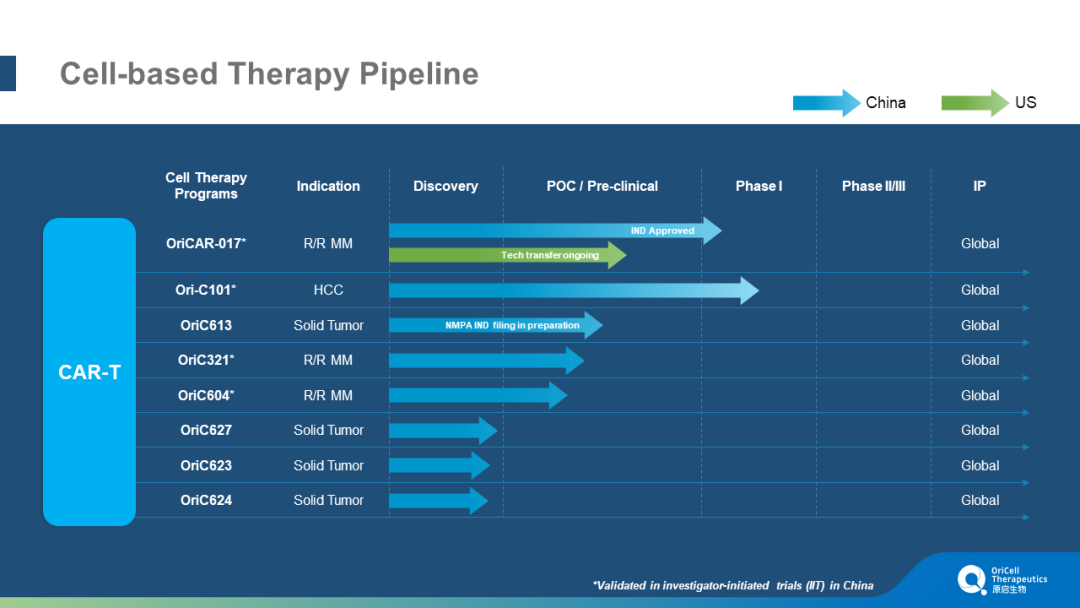
原启生物产品管线
原启生物成立于2015年,致力于肿瘤细胞免疫治疗产品开发,目前已构建基于肿瘤细胞免疫治疗的OriAb、OriCAR等多个专利技术平台,并从抗体工程构建技术、肿瘤免疫微环境调节、T细胞浸润与杀伤能力等方面着手突破了CAR-T治疗实体肿瘤的疗效瓶颈。目前,原启生物建立了针对多个癌种的多个细胞药物管线。