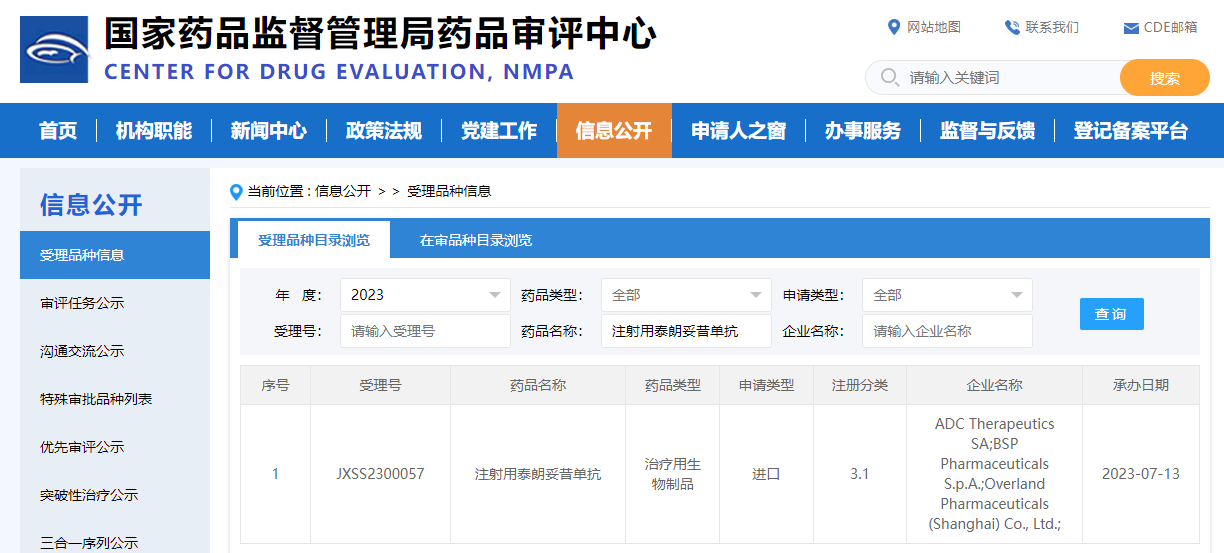
首款靶向CD19的ADC药物国内申请上市,去年销售业绩不足一亿美元
近日,据国家药监局药审中心官网信息显示,瓴路药业/ADC Therapeutics在研的靶向CD19抗体偶联药物(ADC)注射用泰朗妥昔单抗(Loncastuximab tesirine)上市申请已获得受理,申请适应症为单药治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL),这也是国内首个申报上市的靶向CD19的ADC药物。
泰朗妥昔单抗是一款靶向CD19的ADC,根据瓴路药业的介绍,泰朗妥昔单抗与表达CD19的肿瘤细胞结合时,会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素。PBD与DNA小沟结合,形成强效的细胞毒性DNA链间交联,导致DNA复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。而因PBD交联引起的DNA修复机制微小且易于隐藏,因此并不会改变DNA的结构。最终,泰朗妥昔单抗能够使细胞周期阻滞从而导致肿瘤细胞死亡。
2020年12月,ADC Therapeutics与瓴路药业宣布成立合资公司Overland ADCT BioPharma(CY)Limited,后者获得ADC Therapeutics的独家授权,在大中华区和新加坡开发并商业化ADC Therapeutics公司的4个针对难治血液肿瘤和实体肿瘤的ADC药物,其中就包括泰朗妥昔单抗。
2021年4月,泰朗妥昔单抗获得美国FDA加速批准上市,单药用于治疗至少接受过2线及以上系统治疗的复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)成年患者,商品名为Zynlonta,该药也成为全球范围内首个也是唯一一个获批治疗DLBCL的靶向CD19的ADC药物。2022年12月,泰朗妥昔单抗又获得欧洲药品管理局(EMA)的附条件批准。
此次泰朗妥昔单抗在中国的上市申请是基于II期OL-ADCT-402-001研究的积极数据。OL-ADCT-402-001是一项开放性、单臂的II期研究,旨在评估泰朗妥昔单抗单药用于治疗复发/难治性弥漫大B细胞淋巴瘤中国患者的有效性和安全性。该研究主要终点为总体缓解率(ORR),次要终点为缓解持续时间(DOR)、完全缓解(CR)率及无进展生存期(PFS)等。今年4月,瓴路药业曾宣布OL-ADCT-402-001研究达到了主要终点。
此外,瓴路药业目前正在中国开展另一项评估泰朗妥昔单抗联合利妥昔单抗(Lonca-R)对比利妥昔单抗联合吉西他滨及奥沙利铂(R-GemOx)的疗效和安全性的确证性III期ADCT-402-311研究,这也是泰朗妥昔单抗的全球确证性III期注册临床试验。
另据ADC Therapeutics 2022年财报,泰朗妥昔单抗2022的销售业绩为0.749亿美元,整体营收低于预期。2023年第一季度,泰朗妥昔单抗销售额仅1895万美元。