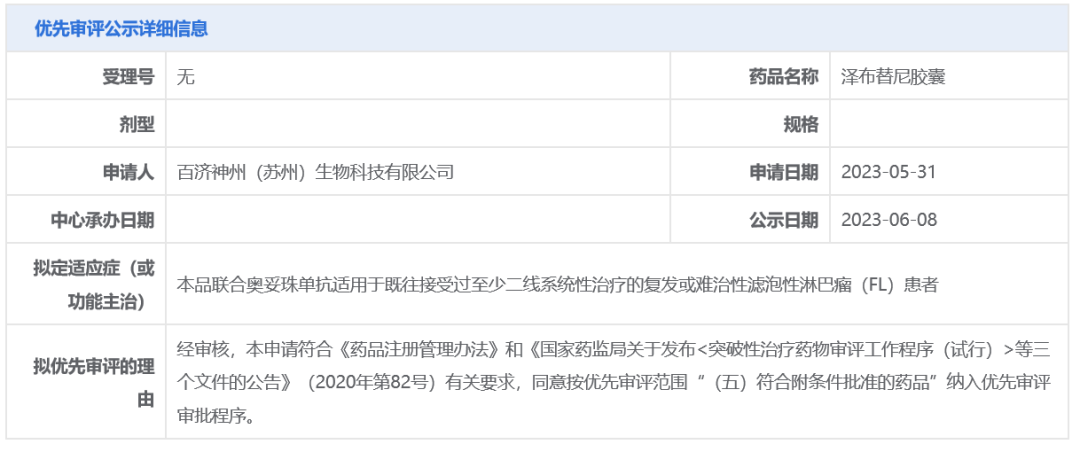
百济神州泽布替尼新适应症拟纳入优先审评
近日,中国国家药监局药品审评中心(CDE)官网最新公示,百济神州BTK抑制剂泽布替尼拟纳入优先审评,拟定适应症为:联合奥妥珠单抗(新一代抗CD20单抗)用于既往接受过至少二线系统性治疗的复发或难治性滤泡性淋巴瘤(FL)患者。
泽布替尼为百济神州自主研发的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂,其设计通过优化生物利用度、半衰期和选择性,实现对BTK蛋白完全、持续的抑制。凭借与其他获批BTK抑制剂存在差异化的药代动力学特征,泽布替尼已被证明能在多个疾病相关组织中抑制恶性B细胞增殖。
2019年11月,泽布替尼获得美国FDA批准上市,实现中国原研新药出海“零的突破”,并于次年6月在国内获批上市,截止目前,泽布替尼已累计在全球超过65个国家及地区获批,在欧美等主流发达国家实现广泛覆盖的同时,也已经在多个新兴市场上市。据百济神州财报显示,泽布替尼今年还有望在超过30个市场取得新增的药政批准。今年1月,泽布替尼获得FDA批准用于治疗CLL/SLL(小淋巴细胞淋巴瘤)成人患者,今年5月,该适应症也获得国家药监局批准,成为国内唯一获批用于CLL/SLL一线治疗的新一代BTK抑制剂。
泽布替尼自获批以来,销量一路突飞猛进,其2020年至2022年销售业绩分别为4170万美元、2.18亿美元、38.29亿元,IQVIA数据显示,截至2022年底泽布替尼已成为国内BTK领域市场份额第一的产品,也成成为百济神州重要的业绩增长极之一。
此次泽布替尼被CDE拟纳入优先审评,针对适应症为FL。泽布替尼已在一项治疗复发或难治性滤泡性淋巴瘤(R/R FL)患者的全球2期ROSEWOOD试验中取得积极结果,数据显示,试验达到总缓解率(ORR)的主要终点,泽布替尼联合奥妥珠单抗组ORR为68.3%,奥妥珠单抗单药组为45.8%,中位随访时间为12.5个月。试验中候选药总体耐受良好,安全性结果与既往研究中对两种药物的观察结果一致。在今年的ASCO年会上,ROSEWOOD研究的最新数据公布,中位随访20.2个月的更新分析显示,联合疗法组ORR为69.0%(vs 45.8%),完全缓解率为39.3%(vs 19.4%),18个月持续缓解时间(DOR)为69.3%(vs 41.9%),中位无进展生存期(PFS)为28.0个月(vs 10.4个月)。