美国已上市ADC药物专利布局对中国药企的启示
ADC(Antibody-drug conjugates)药物号称“魔法子弹”,由抗体、连接子和载药三部分组成,兼具抗体的高特异性和细胞毒素的高抗肿瘤活性,同时其定向释放的特性使得安全性更加可控,是目前肿瘤治疗领域的热点研究领域之一,也是竞争最为激烈的领域之一。2023年2月23日,阿斯利康与KYM Bioscience Inc.(其为康诺亚和乐普生物的合资公司,康诺亚占比70%)就潜在世界首创靶向Claudin 18.2的抗体偶联药物CMG901达成合作协议,阿斯利康将基于该合作向KYM Bioscience Inc.支付6300万美元的首付款和超过11亿美元的额外研发和销售相关的里程碑付款,以及高达低双位数的分层特许权使用费。2023年2月24日,NMPA(中国国家药品监管局)官网公示,由阿斯利康和第一三共联合开发和商业化的ADC药物DS-8201(英文商品名Enhertu、中文商品名优赫得)已获得上市许可,获批适应症为HER2阳性乳腺癌。DS-8201的高载药量、高毒性、高均一性、可裂解的连接子所引发的“旁杀者效应”以及靶向泛癌种的HER2靶点,使其在乳腺癌和胃癌的治疗中大获成功,甚至有人将ADC药物研发划分为DS-8201前时代和DS-8201后时代,ADC药物研发领域将进入更加白热化阶段。
药企研发有其自身鲜明的特色:管线未动,专利先行。从立项前的专利检索、专利分析、技术路线可行性分析,到贯穿药物研发和商业化全过程的FTO检索,专利始终与管线如影随形,亦步亦趋。相较于传统的小分子药物和生物药研发,ADC药物特殊的结构决定了该领域的药物研发面临着更为复杂的专利问题。ADC药物的特殊结构使得研发必须至少关注三个组成部分的相关专利。此外,ADC药物的特殊结构决定了其研发成本远高于单独的小分子药物和生物药,药企的专利策略应始终围绕管线,在法律允许的范围内最大限度地拓展管线核心专利的保护期,这需要丰富的专利经验和纯熟的法律技巧。
本文通过分析美国FDA已经批准上市的11款ADC药物(截至2021年12月31日)的专利和结构概况,期待能够给相关企业一些思路和启发。
一、美国FDA已经批准的11款ADC药物专利及结构概况
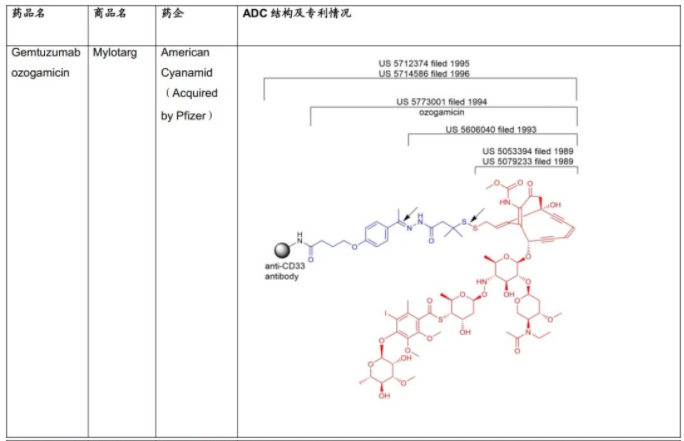
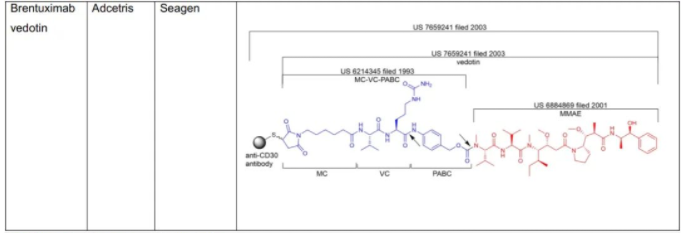
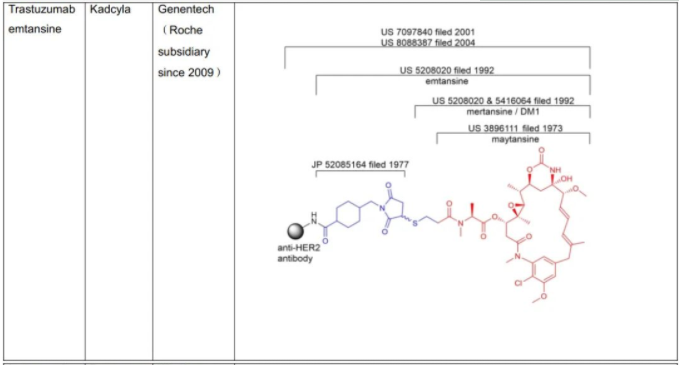
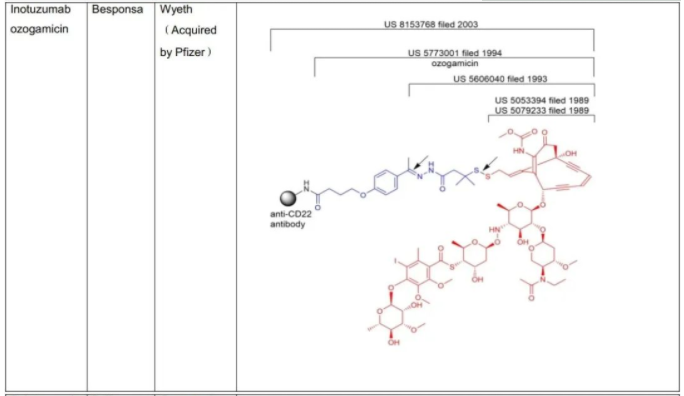
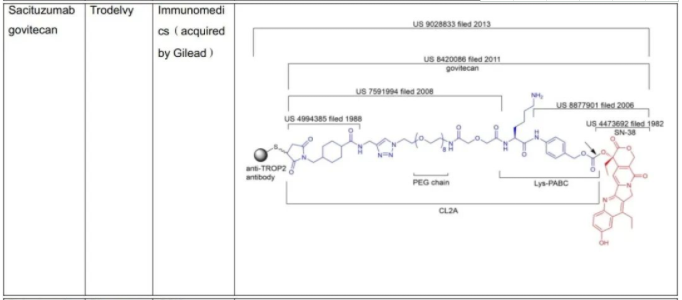
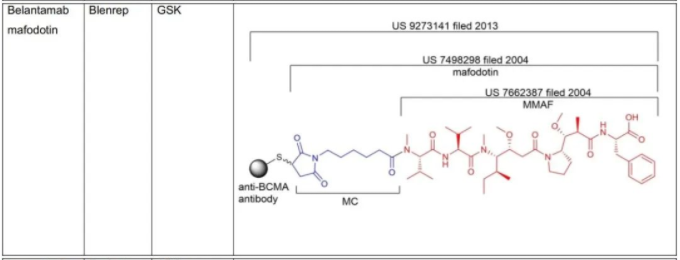
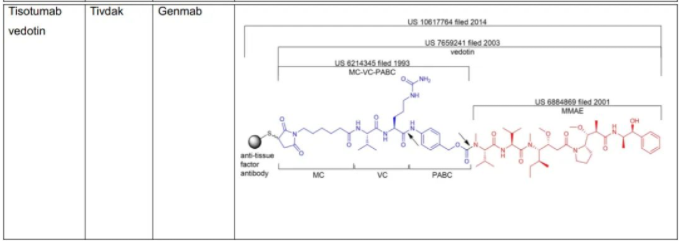
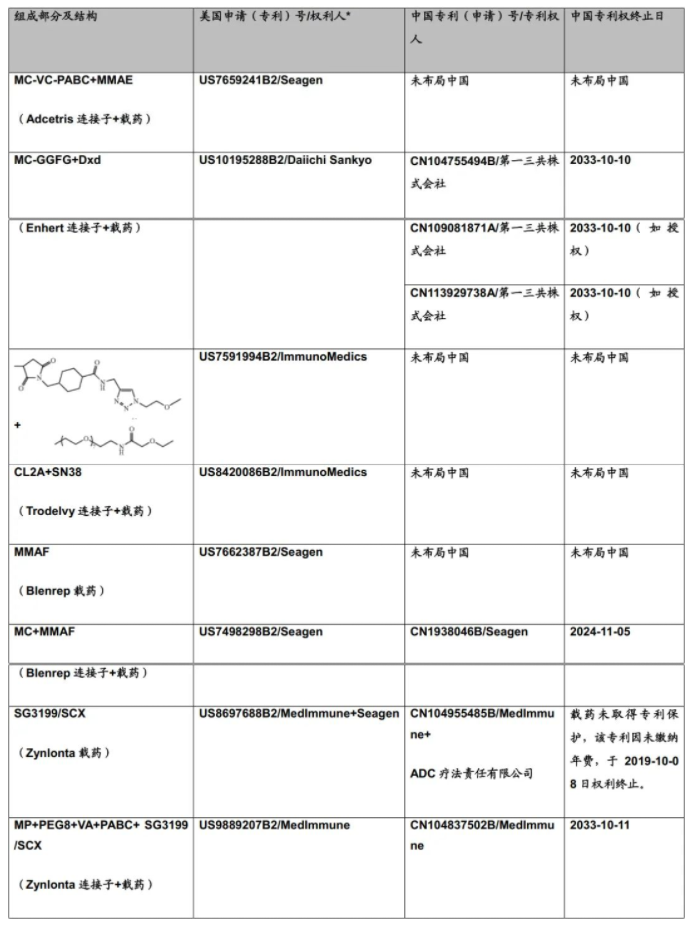
C.S.Brian Chia博士于2022年发表了专利综述文章,将截至2021年12月31日FDA批准的11款ADC药物的专利进行了详尽的描述(doi.org/10.1002/cmdc.202200032),现列表如下:
表1:美国FDA已经批准的11款ADC药物专利及结构概况
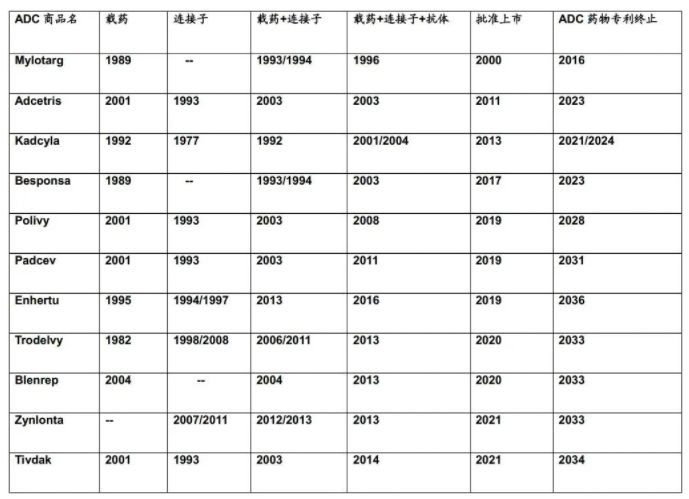
从C.S.Brian Chia博士的研究成果不难发现,列于表1中的ADC药物的专利布局均是根据组成模块分步完成的(表2中列明的载药、连接子、载药+连接子、载药+连接子+抗体均仅为表述各组分专利申请时间的便利,并非指其对应的专利权均同属于同一权利人)。各组模块申请年份、药物批准上市年份及药物专利权终止年份,列表如下。
表2:美国已经批准的11款ADC药物各组成部分的申请年份、药品批准年份、药品专利权终止年份
二、对中国ADC研发企业的启示
(1)并非只有全新的载药、连接子、抗体才可以获得专利保护,在充分、专业检索的基础上,“老药新用”是一个值得尝试的路径。
从表2所载信息不难发现,除Zynlonta中的载药SG3199/SCX是2011年申请的化合物的外,其中不乏DXd、DM1、SN38这样的早期化合物,虽然化学领域的审查标准在中美欧等法域有区别,但总体而言,通过新的连接子偶联已知化合物,在满足专利法其他授权条件的前提下,可以取得专利权。特定情形下(如中国专利法审查标准下的预料不到的技术效果),已知连接子和已知化合物偶联后也有可能获得专利权,但此种情况下的研发立项,需要专业细致的深入检索,叠加与研发部门的协同推进。有些在临床上经过充分验证的连接子专利甚至未布局中国。以Genmab为例,其MC+VC+PABC+MMAE的结构被US7659241B2专利所保护,该专利的同族专利进入了了欧洲、日本、加拿大、澳大利亚等国家,但该专利既未通过巴黎公约途径亦未通过PCT途径进入中国,该结构已经被国内企业采用,且取得了非常好的药效。除此之外,国内药企还可以在以下方向尝试“老药新用”。
对于抗体部分,国内药企可以关注专利权已经终止或专利权临近终止的抗体,在细胞表面抗原靶标数量有限的前提下,那些在临床上广泛使用的抗体药物尤应重点关注。抗体是ADC药物设计的起点,也是影响ADC药物疗效和毒性的基础性因素之一。高靶向性、最小免疫原性、糖基化修饰、抗体依赖性细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)、补体依赖性细胞毒性(CDC)等均为抗体选择之初的重点考量因素。
对于连接子部分,自行开发是一个研发路径,下文将予以讨论。还有一个较为稳妥的路径是采用经过临床验证的连接子或连接子+载药,尤其是专利已经到期或者专利未布局中国的专利值得重点关注,如Genmab的连接子MC+VC+PABC+MMAE的结构。
对于载药部分,除DXd、DM1、SN38、MMAE、MMAF等专利权已经终止或临近终止的化合物外,临床上已经作为成熟的化疗药物使用的化合物在研发立项初期可以纳入尝试,以初步验证效果。如,卫材(Eisai)和百时美施贵宝(BMS)的靶向FRαADC新药MORAb-202,其以甲磺酸艾日布林作为载药,根据其在2021AACR大会公布的数据:I期临床试验中的22例患者中,9例取得部分缓解,1例取得完全缓解,8例病情稳定,展现了潜在的临床获益和可接受毒性。
表3汇总了表1中部分模块的专利保护期信息。
表3:部分结构的专利保护信息 *部分专利申请提交后,可能在审查过程中因授权审查标准进行了权利要求修改,导致获得授权的权利要求范围未涵盖相应结构
(2)充分利用模块化布局、优选权制度、PCT规则以及Bolar例外在专利保护期层面为管线保驾护航。
笔者在行文过程中,在专利检索的过程中发现:相较于美日欧企业,部分国内药企在ADC领域的专利布局习惯于将载药+连接子+抗体一次性申请和公开,放弃采用优先权路径,也不针对ADC的三个模块在整体战略的基础上分开布局。此种做法的益处是费用相对较低,但弊端在于,无法为管线做好专利生命周期管理,一旦专利到期,管线再无壁垒。从表2总结的信息不难看出,头部药企针对ADC药物的专利布局采用的是分模块分别布局,战略上再行整合,有些药物实际的专利保护期远长于20年。优先权日虽然不是专利保护期的起算日,但采用优先权规则可以在专利保护期和丧失新颖性创造性之间达成平衡,在某种意义上,是对专利保护期的变相延长。优先权制度的另一显见益处是,避免管线过早公开。
按照中国现行专利法和审查指南的相关规定,自优先权日起最长32个月内,PCT专利申请可以进入中国,这对处于起步阶段的Biotech公司而言,是难得的管线验证期。32个月的时间足以让企业从ADC药物的设计开始获得初步的临床前试验数据,充分利用好PCT规则,能够为企业的研发争取更长的时间考虑专利的全球布局。
Bolar例外为主流法域所认可和接受。在中国,法律豁免了药企在研发阶段的专利侵权责任,因此,利用好Bolar例外规则也可以为企业研发节省更多等待的时间。
(3)在宽宽的赛道中深深地耕耘也是不错的选择
创新是医药企业应该具备的基因内核,“老药新用”是一种创新,沿着既有路径更深地挖掘更是一种创新。ADC药物研发领域是一片广阔的蓝海,深邃的海洋能够容纳企业深入地挖掘。
以连接子模块为例,连接子分为可切割连接子和不可切割连接子,而可切割连接子又可分为化学可切割连接子和酶可切割连接子。酶可切割连接子又可分为酶激活连接子、硫酸酯酶可切割连接子、半乳糖苷酶可切割连接子、β-葡萄糖醛酸酶敏感连接子等;化学可切割连接子可进一步细分为谷胱甘肽敏感的二硫键连接子、酸敏感可裂解连接子,每一个细分领域均可以深深挖掘。
再以载药为例,除了“老药新用”外,ADC头部药企同时也在研发新的载药或在“老药”基础上进行改构。如隐粘菌素(Cryptomycins,CR)是一个具有抗肿瘤活性的六元大环二肽家族,但在有效剂量下,毒性是临床不能接受的。Genetech的研发人员通过将苯转化为苄胺以解决这一问题。载药的改构不仅涉及改构后的药物是否能与靶标结合,也涉及偶联过程中的诸多技术细节,在某些情形下,改构的平台技术可能已经专利化。
对于抗体模块,有两条路径可以选择。一是探寻新的适合作为ADC药物靶标的新的靶点,这也是诸多跨国药企矢志不渝的方向;另一路径,是在靶点有限的现实环境中,争取研发出best-in-class的新惊喜。无论哪一条道路,对于国内药企来说,都是一条艰辛的道路。
但共性的一点是,任何一个模块任何一个细分方向的深入挖掘,企业在研发立项前均应做好充分的专利检索,避免重复研发,更应避免研发成果落入竞争企业的专利权范围内。研发的竞争是技术的竞争,其本质是时间、效率和信息获取能力的竞争。