又一款阿尔茨海默病新药或要来了,已在华申报上市
日前,据国家药监局药审中心官网信息显示,卫材/渤健共同开发的阿尔茨海默病新药仑卡奈单抗(lecanemab)注射液的上市申请已获得受理,适应症为轻度阿尔茨海默症(AD)和阿尔茨海默症(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。
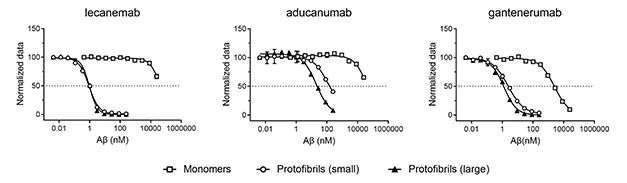
据了解,Lecanemab是一种抗Aβ原纤维抗体,可选择性与较大的可溶性Aβ原纤维结合,用于治疗经证实大脑中存在淀粉样病变、伴有AD引起的轻度认知障碍(MCI)和轻度AD的患者,曾有研究者把Lecanemab与AD新药Aducanumab,以及罗氏的在研AD药物Gantenerumab就分别对Aβ各种形式聚合物的结合能力作了横向对比,结果显示Lecanemab结合75-300kD较小原纤维的亲和力是Gantenerumab的10倍、Aducanumab的100倍;对于300-500kD的较大的原纤维,Lecanemab亲和力则是Aducanumab的25倍。
此次Lecanemab在中国的上市申请是基于一项全球、双盲、安慰剂对照的的验证性III期Clarity AD研究,今年11月,卫材已公布了Clarity AD临床研究的全部数据,相关研究结果也同步发表在《新英格兰医学杂志》上。
据了解,Clarity AD研究纳入了1795名早期AD患者,即经正电子断层发射断层扫描(PET)或脑脊液证据确诊的AD相关轻度认知障碍或轻度痴呆患者。参与者随机分配至治疗组和安慰剂组,接受10mg/kg/双周静脉注射治疗,主要终点为临床痴呆评定量表总评分(CDR-SB)评分较基线变化,次要终点为PET检测的淀粉样蛋白负荷变化和AD评定量表认知部分(ADAS-cog14)、AD综合评分(ADCOMS)和AD协作研究-轻度认知功能障碍者日常生活能力量表(ADCS-ADL-MCI)评分变化。
试验结果显示,治疗18个月后,主要研究终点CDR-SB较基线变化为-0.45,达到显著统计学差异(P<0.001),Lecanemab治疗组与安慰剂组相比认知衰退幅度减缓27%。同时,数据还显示,在所有的关键次要终点中, ADAS-Cog14较基线变化为-1.44,达到显著统计学差异(P<0.001),治疗组衰退幅度与安慰剂组相比减缓了26%。ADCOMS较基线变化为-0.005,达到显著统计学差异(P<0.001),治疗组衰退幅度与安慰剂组相比减缓了24%。ADCS-MCI-ADL治疗组衰退幅度与安慰剂组相比减缓了37%。另外,分期亚组(MCI-AD或轻度AD)、是否携带ApoE4基因、是否同时使用其他获批治疗AD的药物或地区差异(北美、亚洲、欧洲) 的患者均显示CDR-SB、ADAS-Cog14和ADCS-MCI-ADL的结果一致。
同时,还有698名患者接受了PET检查,18个月时治疗组脑内淀粉样蛋白负担变化为-55.48 centiloids(一种评价斑块水平的指标),安慰剂组则为3.64 centiloids。
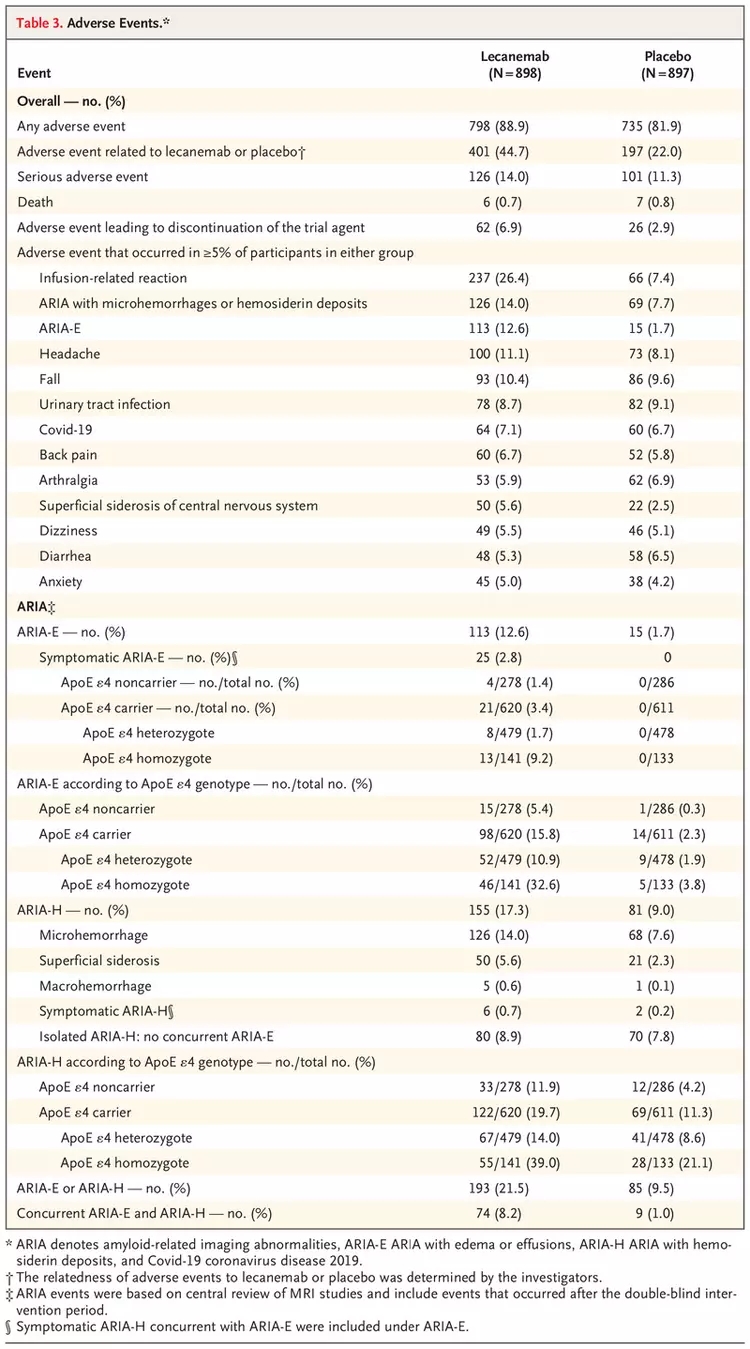
安全性方面,lecanemab治疗组出现了6例死亡,安慰剂组出现了7例死亡;调查人员认为死亡与lecanemab治疗及ARIA现象(淀粉样蛋白相关成像异常,可能是大脑水肿(ARIA-E)或微出血(ARIA-H)的迹象)均无关。lecanemab治疗组14.0%的患者发生了严重不良事件,安慰剂组11.3%的患者发生了严重不良事件。最常见的严重不良事件是输注相关反应、ARIA-E、房颤、晕厥及心绞痛。
也正是基于上述结果,虽Lecanemab尚不能完全阻止认知下降,但其也成为了第一款在第三阶段临床试验中明显抑制阿尔茨海默症发展的药物,国际阿尔茨海默病协会曾称这一积极数据是“迄今为止治疗阿尔茨海默病临床试验中最令人鼓舞的结果”。
去年9月,卫材已开始向FDA滚动申报Lecanemab的相关材料,今年7月,FDA受理了Lecanemab的BLA申请,并授予优先审评资格。
另值得一提的是,与Lecanemab同样基于Aβ沉积假说的渤健/卫材的另一款已上市的阿尔茨海默病药物Aduhelm相比,在药物机制方面,虽然两者都是针对β淀粉样蛋白,但Lecanemab针对的是尚未结块的淀粉样蛋白。在合作方式上,Aduhelm由渤健负责开发且主导商业化,卫材参与分成,Lecanemab则由卫材主导开发,双方共同负责商业化推广,卫材保有最终决策权。商业化方面,Aduhelm自获批上市以来就颇受争议,先后遭遇了上市受挫、限制使用、销量低迷、销售团队解散等一系列负面影响。据渤健财报显示,2022年上半年Aduhelm销售收入为290万美元,自2021年6月上市以来共收入590万美元。同时,渤健曾在今年一季度报中表示,将撤回Aduhelm在欧洲的上市申请,并基本取消Aduhelm的商业化措施。