宁光院士主持,君实新冠口服药VV116与辉瑞Paxlovid开展头对头III期试验
4月19日,据中国临床试验注册中心显示,苏州旺山旺水生物医药登记了一项评价JT001(VV116)对比辉瑞Paxlovid早期治疗轻-中度新型冠状病毒肺炎(COVID-19)有效性和安全性的多中心、单盲、随机、对照III临床研究。
头对头试验针对早期治疗新冠轻、中症
VV116是中国科学院上海药物研究所、中国科学院武汉病毒研究所、旺山旺水生物医药有限公司等多家机构联合开发的一款新型口服核苷类抗SARS-CoV-2药物,通过靶向RNA依赖的RNA聚合酶(RdRp)抑制病毒RNA的合成。临床前药效学研究显示,VV116在体外对新冠病毒原始株和已知突变株都表现出显著的抗病毒作用。2021年9月,君实生物与旺山旺水达成合作协议,共同承担VV116在全球范围内的临床开发和产业化工作。2021年12月30日,VV116在在乌兹别克斯坦获得紧急使用授权。
Paxlovid是辉瑞开发的全球首款针对新冠病毒的口服3CL蛋白酶抑制剂,于今年2月11日获药监局附条件进口批准,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,并已被纳入《新型冠状病毒肺炎诊疗方案(试行第九版)》。
此次临床研究将入组480例患者,使用VV116与Paxlovid各240人,3期临床试验从2022年4月1日至2022年12月31日。入组人员为有基础疾病的,且症状评分≥2分的新冠确诊病人,试验地点为上海市瑞金医院,研究负责人是瑞金医院院长、中国工程院院士宁光。
给药方案为:治疗组:JT001(VV116)600mg Q12H×1天, 300mg Q12H×4天;对照组:Paxlovid,奈玛特韦片300mg+利托那韦片100mg, Q12H×5天。
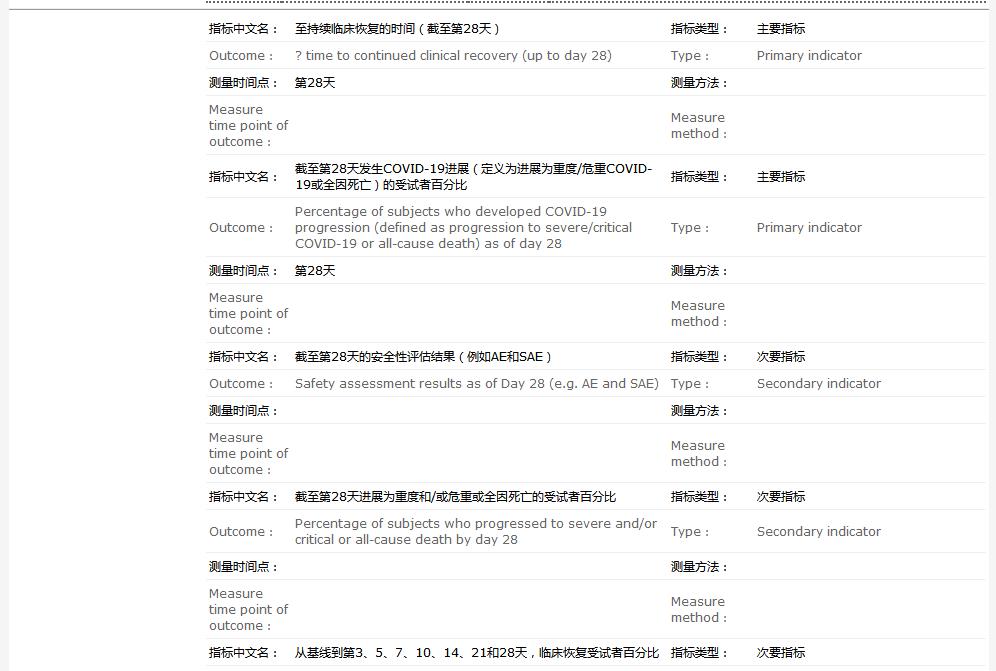
研究目的共有5项:包括评价JT001(VV116)与Paxlovid相比对总体受试者临床状况的影响;评价JT001(VV116)与Paxlovid相比安全性特征;评价JT001(VV116)与Paxlovid相比截至第28天COVID-19临床变化;评价JT001(VV116)与Paxlovid相比截至第14天的SARS-CoV-2的变化;评价JT001(VV116)与Paxlovid相比截至第10天胸部CT扫描的变化。
临床试验的主要终点为至持续临床恢复的时间(截至第28天)以及截至第28天发生COVID-19进展(定义为进展为重度/危重COVID-19或全因死亡)的受试者百分比。
有行业人士表示,考虑到目前Paxlovid是目前全球最为看好的新冠抗病毒口服药,VV116选择与其直接进行比较,一旦显示出优效、甚至是非劣效,都将给VV116的市场前景带来极大帮助。
已公布VV116 3项I期临床数据
目前,关于VV116治疗新冠的效果有多项研究正在国内外开展,今年3月,君实生物曾公布了关于VV116的3项I期临床数据。
根据君实生物的公告,上述三项的临床研究结果显示,VV116口服吸收迅速;重复给药可维持有效抗病毒浓度;普通饮食对VV116药物暴露量无影响,安全性方面,VV116在健康受试者中显示出令人满意的安全性及耐受性。3项研究均未报告死亡、未发生严重不良事件(SAE)、未发生3级及以上不良事件(AE),也未出现导致停药及中断治疗的不良事件。所有不良事件均在未治疗或未干预情况下恢复。相较同类药物在过往报告的数据,VV116具有较低的肝毒性风险。
基于上述I期研究的积极结果,君实生物与旺山旺水已启动一项国际多中心、双盲、随机、安慰剂对照、II/III 期临床研究(NCT05242042),针对轻中度 COVID-19 患者。该研究由复旦大学附属华山医院教授张文宏和上海市公共卫生临床中心教授沈银忠联合主持,旨在评价 VV116 用于轻中度 COVID-19 患者早期治疗的有效性、安全性和药代动力学。
同时,另一项在中重度 COVID-19 受试者中评价 VV116 对比标准治疗的有效性和安全性的国际多中心、随机、双盲、对照 III 期临床研究也正在进行中。
此外,Nature旗下刊物《信号转导和靶向治疗》日前在线发表了VV116作为潜在呼吸道合胞病毒(RSV)抑制剂的临床前体内药效研究成果。研究发现,VV116在RSV多个敏感细胞系上具有优异的抗病毒效果。在小鼠模型上,VV116具有较高的口服生物利用度、良好的组织分布和显著优于利巴韦林的抗病毒效果,且能缓解肺部组织的病理损伤情况,君实生物方面称,该研究为治疗RSV感染提供了有价值的临床候选药物。
Paxlovid 2/3期临床数据显示死亡风险降低89.1%
近日,一项关于Paxlovid的2/3期临床数据在新英格兰医学期刊上也正式发表。
该2/3期临床共有2102例患者参与并完成研究,按1:1随机分组,接受Paxlovid或安慰剂治疗,每12小时一次,持续5天(共10次给药)。
这项在未接种疫苗者中进行的2-3期试验的结果证明了nirmatrelvir(300 mg)与利托那韦(100 mg)口服给药每12小时一次,持续5天的疗效。在分析中发现该方案在进展为重度疾病高风险的非住院成人中,COVID-19相关住院或第28天因任何原因死亡的相对风险降低89.1%。在症状发作后3天内和5天内开始治疗的患者中观察到相对风险分别降低88.9%和87.8%,Paxlovid组中发生0例死亡,安慰剂组中发生13例死亡。
该疗效得到了主要终点亚组分析的支持;无论年龄、性别、人种、BMI、基线血清学状态、病毒载量如何,接受Paxlovid治疗的患者或者无COVID-19相关住院或全因死亡,或者风险显著低于安慰剂组,共存疾病或基线时共存疾病的数量。与安慰剂相比,Paxlovid治疗也与第5天SARS-CoV-2病毒载量额外降低10倍相关。