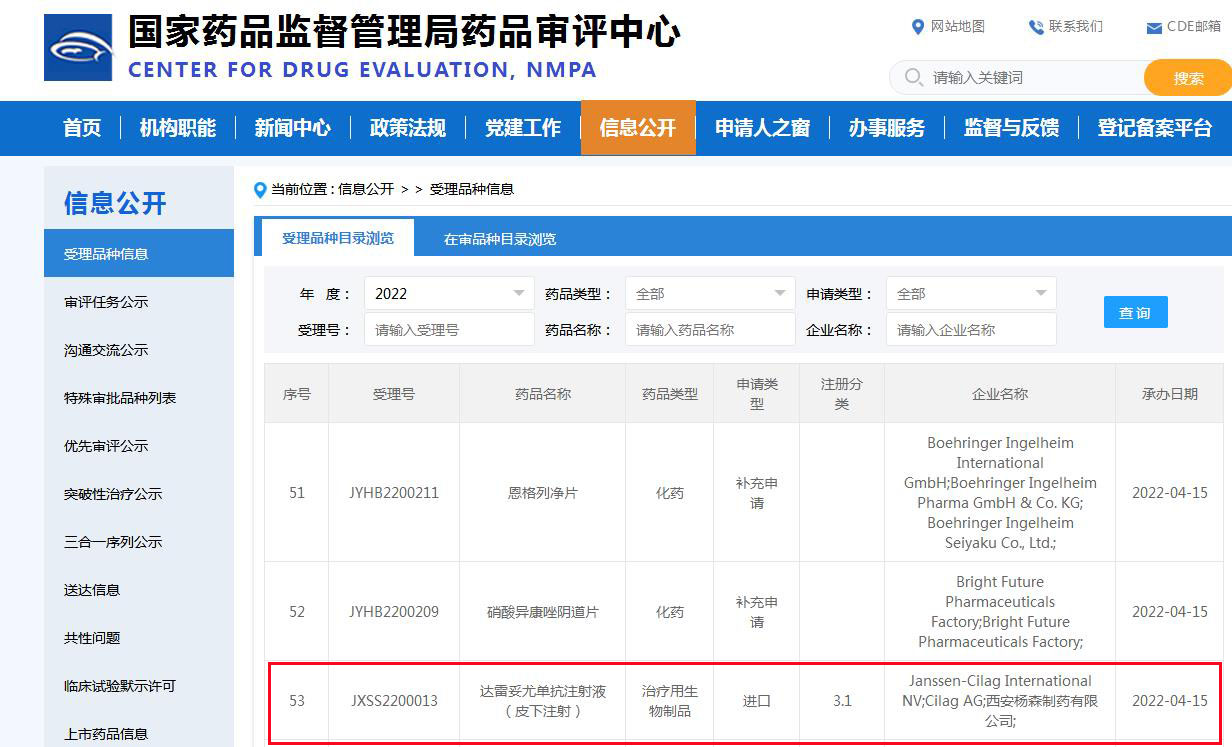
达雷妥尤单抗皮下注射剂在华又递交一个新适应症上市申请
近日,据国家药监局药审中心官网显示,强生旗下杨森公司CD38单抗达雷妥尤单抗注射液(皮下注射)在中国递交了一项新适应症上市申请,并获得受理。
公开资料显示,抗雷妥尤单抗(daratumumab)是全球首个获批的靶向作用于CD38的全人源单克隆抗体。研究显示,达雷妥尤单抗能够以高亲和力的方式,特异性识别在多发性骨髓瘤恶性浆细胞上高表达的CD38,进而通过多种免疫介导机制来诱导肿瘤细胞的死亡。
2015 年,达雷妥尤单抗通过优先审评获得美国 FDA 批准上市,与来那度胺和地塞米松,或者硼替佐米和地塞米松联用,用于曾接受至少一种治疗的多发性骨髓瘤患者;2019 年 7 月,达雷妥尤单抗(静脉注射剂型)获得国家药监局有条件批准上市,用于单药治疗复发和难治性多发性骨髓瘤成年患者,包括既往接受过一种蛋白酶体抑制剂和一种免疫调节剂且最后一次治疗时出现疾病进展的患者,成为国内首个上市的CD38单抗,商品名为兆珂;2021年4月,达雷妥尤单抗获国家药品监督管理局批准,与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药治疗既往至少接受过一线治疗的多发性骨髓瘤成年患者。
2021年10月,达雷妥尤单抗注射液的皮下注射剂型首次获得国家药监局批准,与硼替佐米、环磷酰胺和地塞米松联合用药治疗新诊断的原发性轻链型淀粉样变患者,达雷妥尤单抗皮下注射剂型是由达雷妥尤单抗和重组人透明质酸酶PH20(rHuPH20)组成的固定剂量复方,与该产品静脉注射剂相比,可以在大约3到5分钟内给药,能够将患者的给药时间从几小时缩短到几分钟。
目前,达雷妥尤单抗的皮下注射剂型已有两项适应症获得美国FDA批准,分别为多发性骨髓瘤和轻链淀粉样变性的成年患者,由此,推测此次其在中国申请的新适应症应为多发性骨髓瘤。
另据强生2021年财报,达雷妥尤单抗全球销售业绩为60.23 亿美元,相较于2020年的41.90 亿美元增幅达43.8%,已然成为强生肿瘤业务中的重磅炸弹药物。