全球首次,体内CRISPR基因编辑治疗用于儿童患者
4月11日,基因组编辑企业Editas Medicine宣布对参加BRILLIANCE临床试验的首位儿科患者进行实验性CRISPR基因编辑药物EDIT-101的给药,该试验旨在测试EDIT-101治疗Leber先天性黑蒙10型(LCA10)的安全性,这也是全球首次在体内对儿科患者进行CRISPR基因编辑实验药物给药。
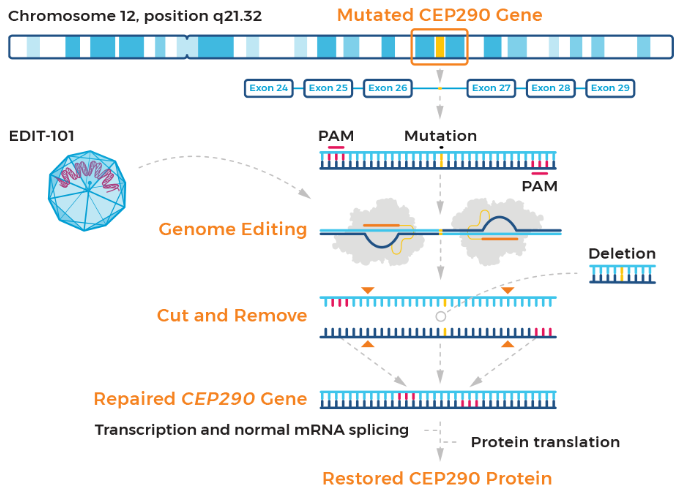
先天性黑蒙(LCA)是一类遗传性视网膜退化疾病,由至少18个不同基因的突变引起,是遗传性儿童失明最常见的原因。LCA10是LCA中最常见的类型,约占所有患者的20%-30%,它的病因是CEP290基因上的突变,目前没有可用的治疗选择。
EDIT-101是一种CRISPR/Cas9基因编辑药物,它将编码Cas9核酸酶变体SaCas9的基因和两个指导RNA(gRNA)装进AAV5载体中,通过视网膜下注射将基因编辑系统递送到感光细胞中。gRNA指导的基因编辑可以消除或逆转CEP290基因上的致病突变,从而改善感光细胞功能,为患者带来临床益处。此前EDIT-101已获得美国FDA认定的罕见儿科疾病和孤儿药称号,以及欧洲药品管理局(EMA)认定的孤儿药称号。
2020年3月,Editas和艾尔建联合宣布EDIT-101治疗先天性黑蒙症10型(LCA10)的I/II期临床试验已完成首例成人患者给药,2021年9月,初步数据出炉,结果显示在安全性方面未观察到严重不良事件和剂量限制性毒性;同时,在两名接受中等剂量治疗的成人患者中发现支持临床获益的疗效信号,Editas预计将在2022年下半年提供 BRILLIANCE试验的临床更新。
此次开展的也是全球首次体内CRISPR基因编辑治疗用于儿童患者,在独立数据监测委员会(IDMC)批准后,Editas开始在BRILLIANCE试验中注册儿童中剂量队列,该队列是基于对成人患者低剂量和中剂量水平的临床试验安全性数据的分析,Editas计划在2022年上半年完成儿童中剂量测试,并预计今年将启动儿童高剂量测试。
Editas的董事长、总裁兼首席执行官James C. Mullen表示:“在BRILLIANCE试验中进行首例儿科患者给药,标志着CRISPR基因编辑药物有望安全有效治疗LCA10,这是一个重要的里程碑,目前,尚未有获批的LCA10治疗方法,我们期待在今年晚些时候分享BRILLIANCE试验的最新进展,包括更多的临床数据。”