创响生物治疗中重度斑块状银屑病III期关键性临床研究申请获CDE批准
创响生物(Inmagene Biopharmaceuticals)今日宣布,中国国家药品监督管理局药品审评中心(CDE)批准了其候选药物izokibep (IMG-020) 用以治疗中重度斑块状银屑病的III期关键性临床研究申请。
此次临床试验(代码ABY-035-301)是一项多中心、随机、双盲、安慰剂对照的研究,旨在收集关键性临床数据,以支持该产品在包括中国在内的多个国家的上市注册申报。在此前针对银屑病以及银屑病关节炎的全球多中心二期临床研究中,该产品已展示了良好的有效性和安全性,并达到主要终点。
候选药物Izokibep由创响及其合作伙伴瑞典Affibody AB和美国ACELYRIN, Inc联合开发,三方共同开展针对多个自身免疫相关适应症的国际多中心临床研究。针对银屑病、强直性脊柱炎和大动脉炎等适应症,创响领导全球临床研究的设计、申报和运营。
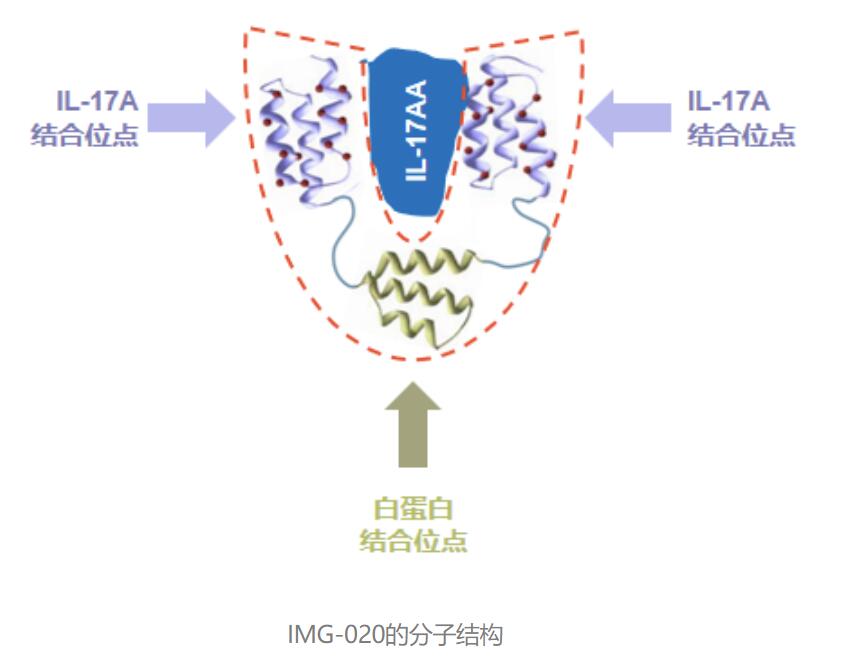
候选药物Izokibep是一种新型的双特异性融合蛋白,可有效靶向IL-17A和血清白蛋白,其分子量是普通抗体的约1/8,对IL-17A的表观亲和力是典型IL-17A抗体的大约1000倍。因为对白蛋白具有很强的亲和力,izokibep在人体内显示了较长的半衰期,并可能在病灶富集。Izokibep在大肠杆菌系统中生产,据估算,在量产阶段,其单位剂量的生产成本应小于典型抗体药物的1/20。
Izokibep的剂型为皮下注射,已在针对银屑病和银屑病关节炎的全球二期临床试验中达到了主要终点。
银屑病俗称牛皮癣,是一种常见的、以皮肤一系列连锁细胞病变为特征的慢性炎症性皮肤病,影响中国约0.5%的人口以及西方国家约2%~4%的人口。该病病程较长,易复发,许多患者终生不愈, 且约有一半患者为中度至重度,对生活的不良影响很大。其中斑块状银屑病最为常见,约占所有病例的80-90%。