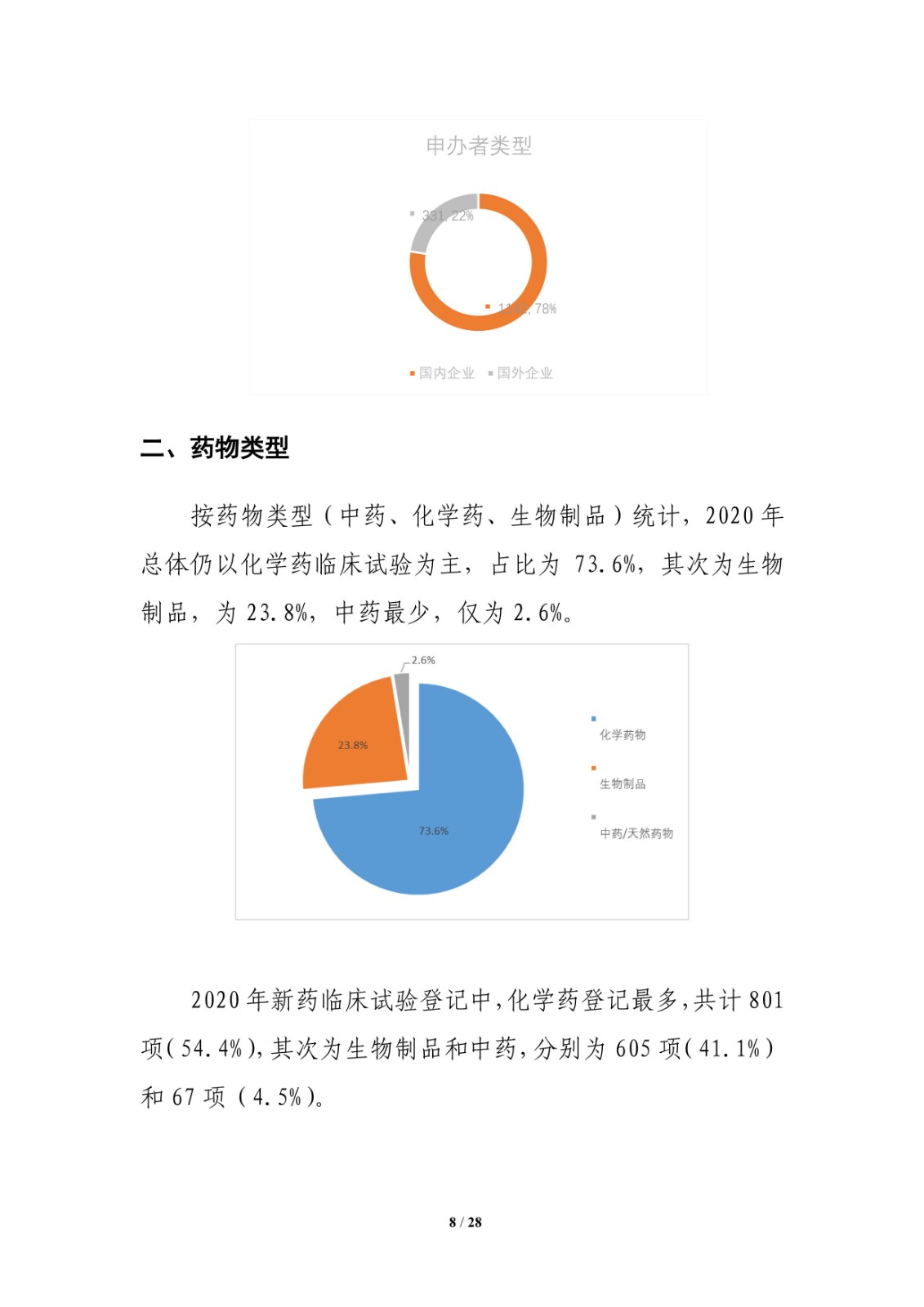
临床试验药物品种前10位靶点,中国新药注册临床试验现状年度报告(2020)
2021年11月10日,国家药品监督管理局药品审评中心(CDE)发布了《中国新药注册临床试验现状年度报告(2020年)》,首次对中国新药注册临床试验现状进行了全面汇总分析,旨在全面掌握中国新药注册临床试验进展,加强药品监管能力建设。
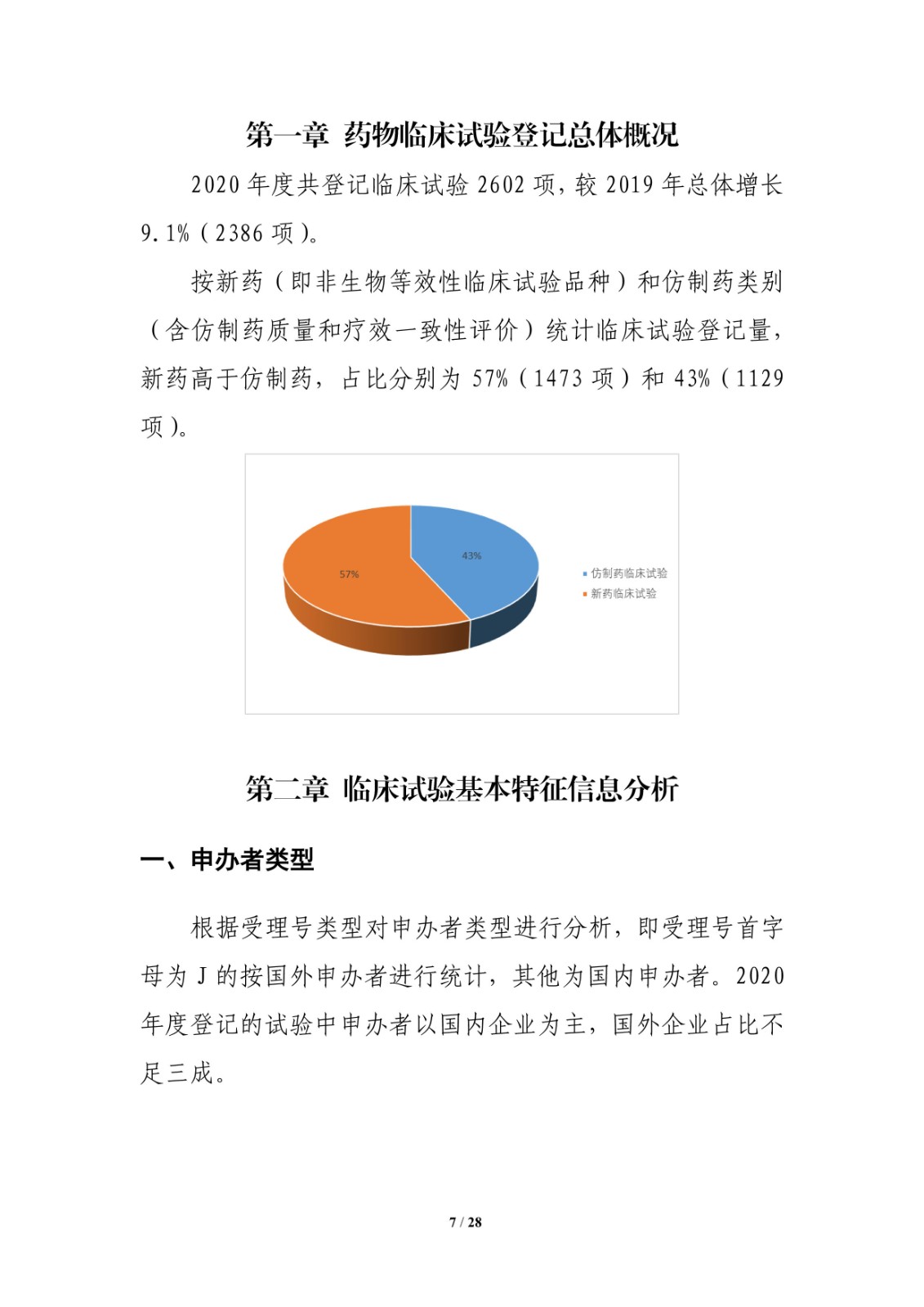
本报告根据2020年度登记的药物临床试验信息,从申办者类型、药物类型、试验品种、适应症、试验分期、特殊人群试验、临床试验的组长单位、启动耗时和完成情况等角度对临床试验的整体进展、主要特点、变化趋势、和突出问题等进行汇总、梳理和分析。
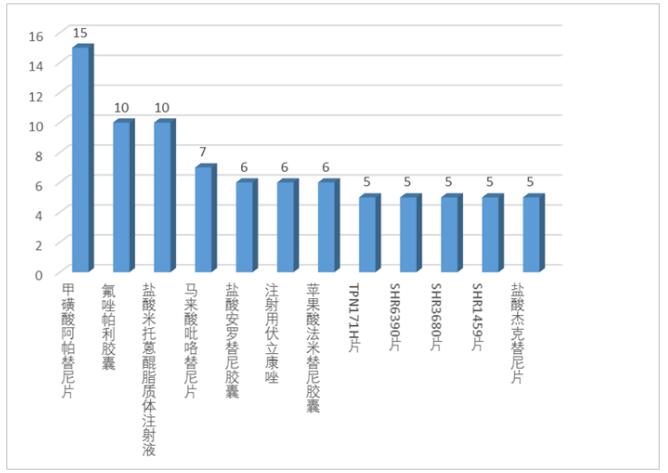
根据报告,化学药临床试验前10位品种基本为抗肿瘤药物,其中甲磺酸阿帕替尼片开展试验最多,为15项,其次分别为盐酸米托蒽醌脂质体注射液和氟唑帕利胶囊,均为10项。
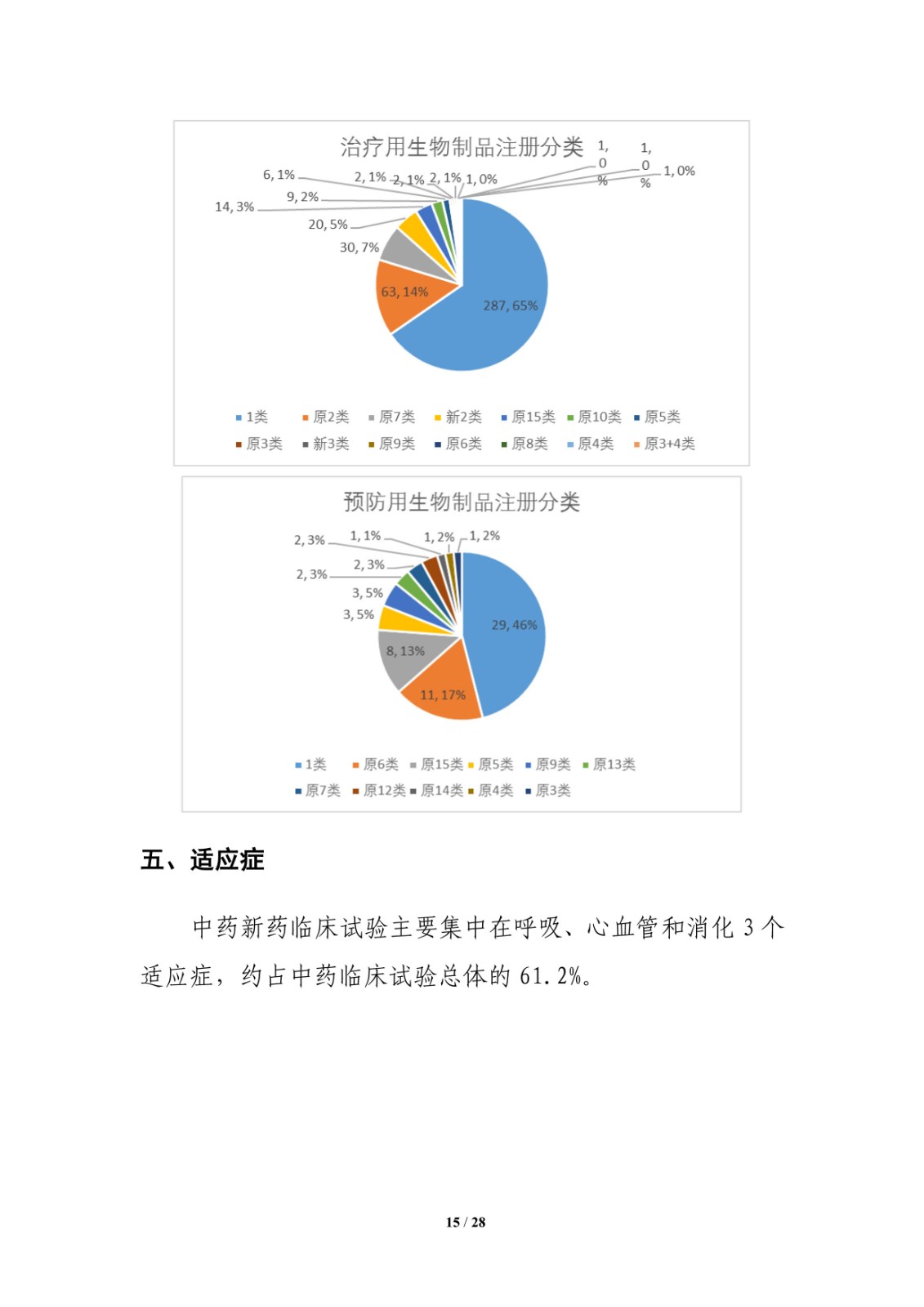
生物制品开展临床试验的前10位品种主要为治疗用生物制品,其中重组人源化抗 PD-1 单克隆抗体注射液开展试验数量最多,为17项,其次分别为阿替利珠单抗注射液和帕博利珠单抗注射液,均为11项;预防用生物制品涉及2个品种,分别为新型冠状病毒灭活疫苗(Vero 细胞)和四价流感病毒裂解疫苗,分别开展10项和8项临床试验。
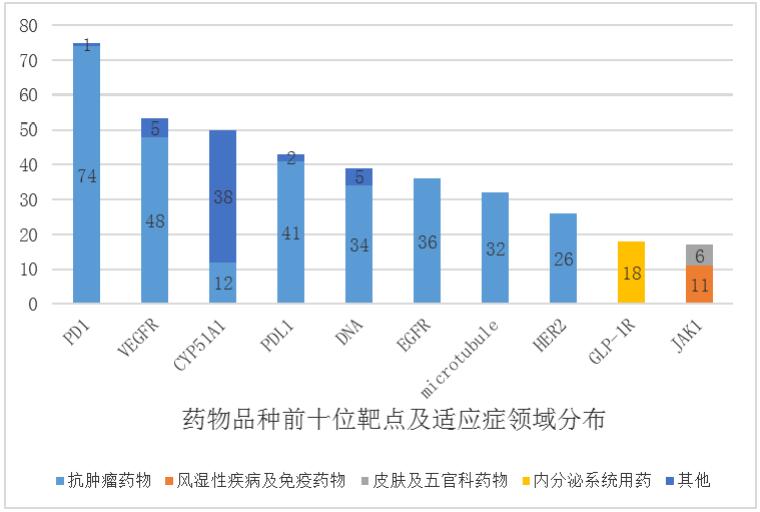
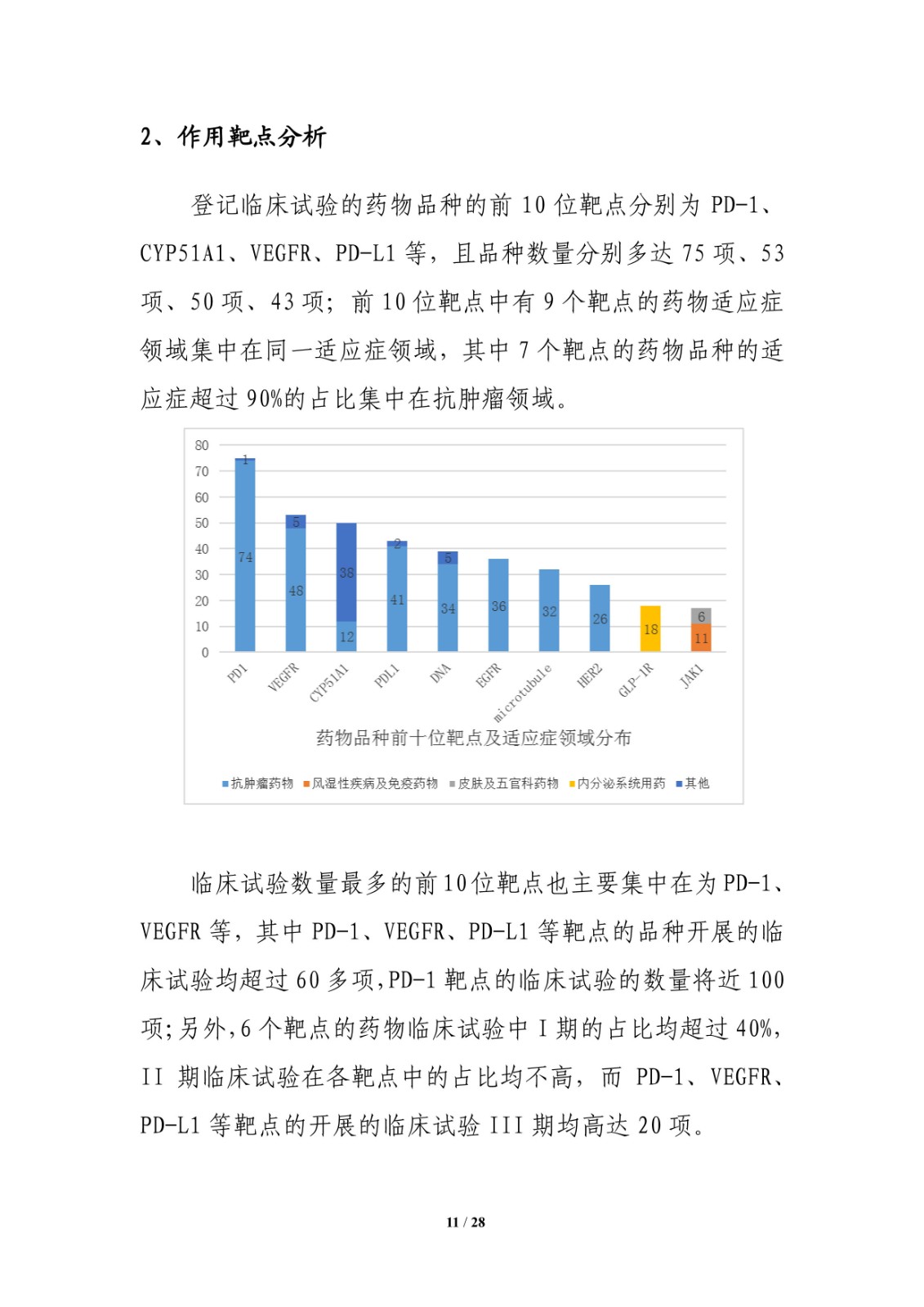
同时,从作用靶点来看,登记临床试验的药物品种的前 10 位靶点分别为 PD-1、CYP51A1、VEGFR、PD-L1 等,且品种数量分别多达 75 项、53项、50 项、43 项;前 10 位靶点中有 9 个靶点的药物适应症领域集中在同一适应症领域,其中 7 个靶点的药物品种的适应症超过 90%的占比集中在抗肿瘤领域。
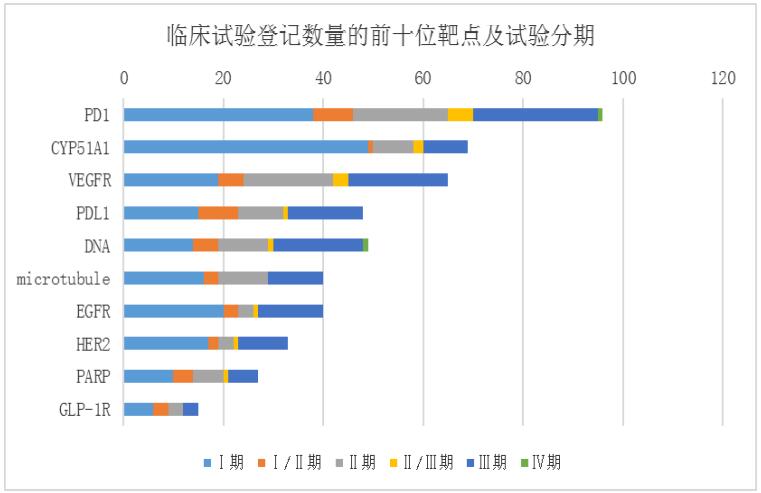
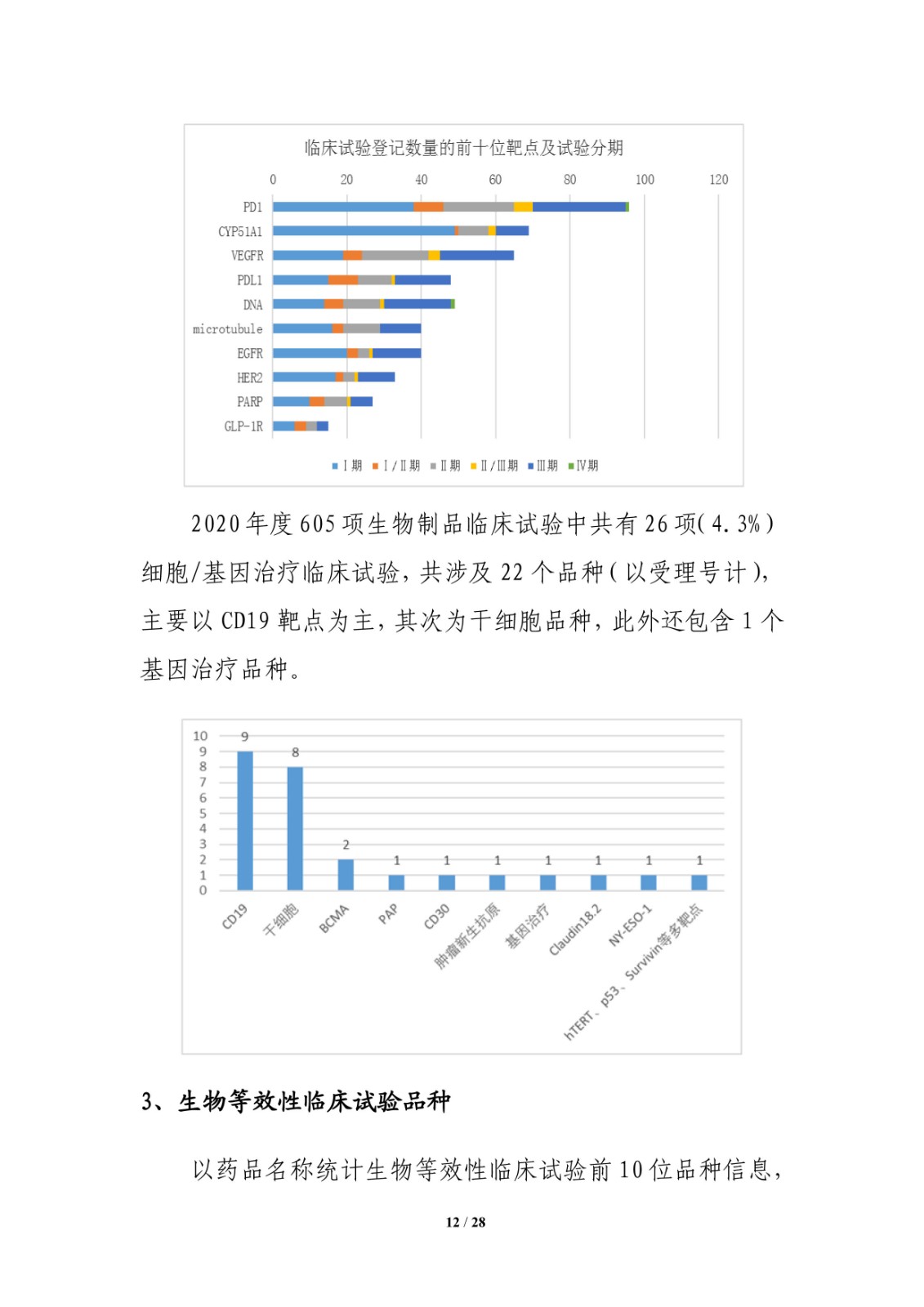
临床试验数量最多的前10位靶点也主要集中在为PD-1、VEGFR 等,其中 PD-1、VEGFR、PD-L1 等靶点的品种开展的临床试验均超过 60 多项,PD-1 靶点的临床试验的数量将近 100项;另外,6 个靶点的药物临床试验中 I 期的占比均超过 40%,II 期临床试验在各靶点中的占比均不高,而 PD-1、VEGFR、PD-L1 等靶点的开展的临床试验 III 期均高达 20 项。
此外,2020 年度 605 项生物制品临床试验中共有 26 项(4.3%)细胞/基因治疗临床试验,共涉及 22 个品种(以受理号计),主要以 CD19 靶点为主,其次为干细胞品种,此外还包含 1 个基因治疗品种。
从2020 年登记的药物临床试验总体上看,我国目前在研药物靶点和适应症领域分布都较为集中,适应症主要集中在抗肿瘤、内分泌和心血管领域,肺癌适应症大部分为非小细胞癌,靶点集中度高,同质化竞争激烈。
附件:《中国新药注册临床试验现状年度报告(2020年)》