诺诚健华“广谱”抗癌药ICP-723获FDA批准开展临床研究
近日,诺诚健华宣布,其自主研发的第二代泛TRK小分子抑制剂ICP-723获得美国食品药品监督管理局(FDA)批准开展临床研究。
此前(2020年5月),诺诚健华ICP-723片获国家药监局临床试验默示许可,适应症为拟用于携带NTRK融合基因的晚期或转移性实体瘤的治疗。2020年10月,ICP-723在中山大学肿瘤防治中心完成首例受试者给药。
据介绍,ICP-723是一种第二代泛TRK(TRK:原肌球蛋白受体激酶)小分子抑制剂,用于治疗携带NTRK(NTRK:神经营养性酪氨酸受体激酶基因)融合基因的晚期或转移性实体瘤,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,以及对第一代TRK抑制剂产生耐药的患者。
TRK家族包括3种称为TRKA、TRKB及TRKC的蛋白质,分别由神经营养性酪氨酸受体激酶基因NTRK1、NTRK2 及NTRK3编码。TRK对维持正常神经系统功能起重要作用。单独的NTRK基因的不必要连接或NTRK基因融合,已被发现是各种不同肿瘤的成因,且在婴儿型纤维肉瘤、唾液腺癌及甲状腺癌中尤其普遍。NTRK融合在软组织肉瘤、甲状腺肿瘤、唾液腺的乳腺类分泌癌、肺癌、大肠癌、黑色素瘤及乳癌等也检测得到,尽管出现比例较低。
临床前数据显示,ICP-723显著阻碍野生株TRKA/B/C,以及突变TRKA 连同耐药突变G595R或G667C的活动,从而强烈证明可克服第一代TRK抑制剂产生的抗药性,具有抗多种实体肿瘤的高活性和良好的安全性,有潜力为NTRK基因融合的实体瘤患者提供广谱抗癌疗法。此次临床试验将主要评估ICP-723在实体瘤患者中的安全性、耐受性及药代动力学特性,并评价ICP-723对NTRK融合基因阳性癌症的抗肿瘤疗效。
目前在中国,ICP-723正在进行I期剂量递增(1毫克、2毫克、3毫克和4毫克)研究中,两名符合条件的NTRK融合阳性患者给药后显示疗效。在第一个周期结束(或第28天)的第一次肿瘤评估中,3毫克组别中的患者肿瘤缩小超过20%;4毫克组别的患者首次评估达到部分缓解(PR)。
据诺华健成科创板申报招股书显示,截至2021年3月31日,全球范围内共有2 款泛 TRK抑制剂获批上市:拉罗替尼和恩曲替尼,属于第一代 TRK 抑制剂。拉罗替尼和恩曲替尼是继 PD-1 单抗药物 Keytruda 之后的两个只与基因分型有关而与肿瘤类型无关的“广谱”抗癌药物。
据诺华健成科创板申报招股书显示,截至 2021年3月31日,全球范围内已有拉罗替尼(Larotrectinib )和恩曲替尼( Entrectinib )等 2 款泛 TRK抑制剂获批上市。Larotrectinib 和 Entrectinib 获批的适应症主要为 NTRK 基因融合的实体瘤。中国尚无泛TRK抑制剂获批上市,处于临床试验阶段的泛 TRK 抑制剂企业如下:
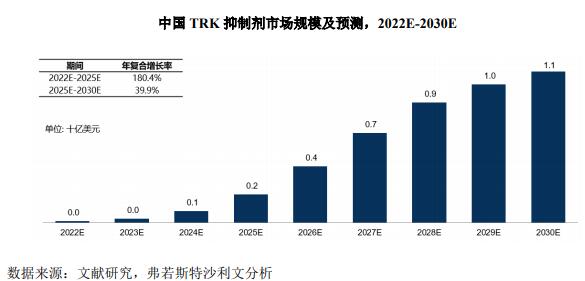
据弗若斯特沙利文分析,TRK 抑制剂中国市场规模在2022 年预计达 0.1亿美元,预计到2025年将以180.4%的复合年增长率达到2.1亿美元,到2030年将以 39.9%的复合年增长率增长至11.4亿美元。