ADC药物的江湖
ADC药物主要应用于抗肿瘤领域,是近年来热门的研究方向之一。
ADC由单克隆抗体(mAb)、偶联链(linker)和细胞毒性小分子(cytotoxin/payload)三部分组成,通过单克隆抗体与肿瘤细胞表面的特异性抗原结合,将细胞毒药物定向递送到肿瘤病灶,对比传统的化药和生物药,明显提升了安全性和有效性。ADC领域在近10年来取得了长足的发展,治疗窗口不断扩大,根据Evaluate Pharma和BCG的预测,全球ADC市场预计2024年将达到129亿美元,2018至2024年的年复合增长率约为35%。
国外ADC药物及市场分析
近一年,国外抗体偶联药物(ADCs)赛道热点不断,先是吉利德以108%的溢价、总值210亿美元收购了ADC公司Immunomedics,引发了不亚于当年119亿美元收购KITE的业内高度关注,辉瑞把两款ADC候选产品转手给了Pyxis。
目前,全球共有11个ADC药物获批,包括Mylotarg(辉瑞)、Adcetris(Seattle Genetics/武田)、Kadcyla(罗氏)、Besponsa(辉瑞)、Lumoxiti(阿斯利康)、Polivy(罗氏)、Padcev(Seattle Genetics/安斯泰来/默沙东)、Enhertu(阿斯利康/第一三共)、Trodelvy(Immunomedics)、Blenrep(GSK)、Akalux(Rakuten Aspyrian)。
从已上市药品的研发企业看,基本是辉瑞、Seattle Genetics、罗氏及阿斯利康四家各有2款,其他3家公司各1款。
辉瑞的Mylotarg是最早获批的ADC药物,2000年5月FDA批准其用于治疗首次复发的CD33阳性急性髓系白血病(AML)的60岁以上患者,不过基于后期Mylotarg未显示出明显的临床益处并存在一定的安全问题,2010年辉瑞将Mylotarg退市直到2017年9月才在再次在美国上市,2020年6月该药扩大适应症至年龄≥1个月、新诊断的CD33阳性AML患者。
Kadcyla和Adcetris则逐渐成长为“重磅炸弹”药物,在2019年双双突破10亿美元关卡,分别达到10.81亿美元和15.72亿美元。Kadcyla已成为HER2阳性乳腺癌在国际上的二线标准治疗方案,2019年5月Kadcyla还被FDA批准为HER2阳性早期乳腺癌患者的辅助治疗方案,市场空间进一步扩容。目前这2款药已分别于2020年1月和5月在中国获批上市,其中Kadcyla(赫塞莱)已纳入2020年医保目录。
作为第三代ADC,Enhertu和Trodelvy势头强劲。2019年12月获批的Enhertu适应症为HER2阳性乳腺癌,鉴于其庞大的患者群体,该药市场前景巨大,同时,今年1月,Enhertu进一步扩大适应症,FDA批准其用于治疗HER2阳性的局部晚期或转移性胃癌和胃食管结合部腺癌患者。根据阿斯利康的年报,Enhertu将成为乳腺癌新晋标准方案,首年销售额2亿美元。
2020年5月获批的Trodelvy则是全球首个TROP-2靶向抗体-药物偶联疗法,也是Immunomedics成立37 年以来上市的首款药物,而该药在上市的头两个月就达到了2010万美元得净销售额。SGEN曾试图以20亿美元收购Immunomedics但未果,最终让吉利德入手。2020年9月吉利德以108%的溢价、总值210亿美元收购了Immunomedics,也将Trodelvy一并收入囊中。行业分析人士此前表示Trodelvy上市后的销售峰值预计将达到10亿美元以上,吉利德的买买买战略为其在ADC盘子里谋得了一块大蛋糕。
此外,其他近几年上市的几款ADC药物均未实现放量,不过据科睿唯安预测,到2024年将有多款年销售额突破10亿美元,包括Polivy和Enhertu等。
除了已上市的11款ADC,据ClinicalTrials.gov的数据显示,截止今年3月19日全球共有155项ADC药物临床试验正在进行,且还在不断增长,同时,各大巨头们也通过买买买不断得扩充自己得ADC管线。2020年11月默沙东以27.5亿美元收购了VelosBio,12月勃林格殷格翰以11.8亿欧元收购了NBE Therapeutics,此外Sterling宣布计划在2021第一季度全面收购英国的ADC Biotechnology。
国内主要的 ADC 药物及研发企业
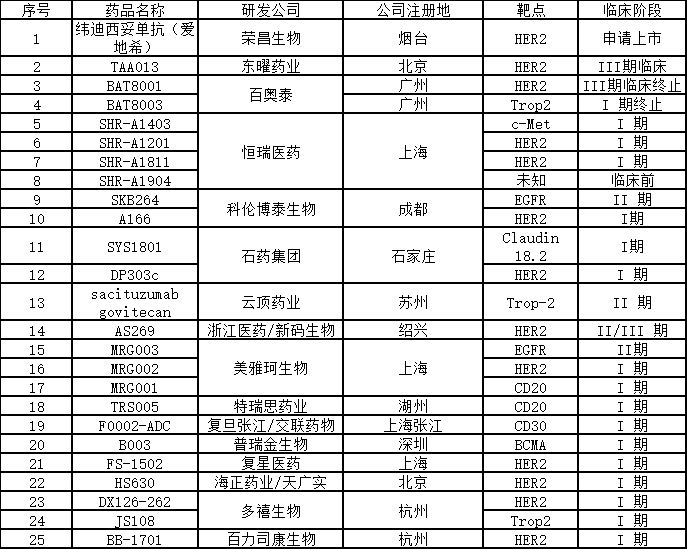
在中国,得益于国内的创新药研发水平不断提升,国内企业在 ADC 药物研发上也迅速跟进。其中荣昌生物的 HER2 ADC 药物 RC48 已经获得国家药监局上市申请正式受理,是国内进展最快的自主研发 ADC 药物;此外有二十多种处于不同阶段临床试验中的ADC药物正在开发中,包括东曜药业、恒瑞医药、科伦药业、云顶新耀、百奥泰、浙江医药等多个公司有产品已经进入临床阶段。除了大多数针对HER2靶点外,其他靶点包括c-Met、EGFR、Trop-2、CD20、BCMA等。
国内ADC药物研发情况 医谷制表
荣昌生物 纬迪西妥单抗
纬迪西妥单抗(商品名:爱地希®,研究代号:RC48)由荣昌生物研发,是国内首个提交新药上市申请的自主开发的抗体-药物偶联(ADC)药物。它以肿瘤表面的HER2蛋白为靶点,能精准识别癌细胞并与之结合,穿透细胞膜进入其内部,从而杀死癌细胞。该药于2015年成为首个获批进入临床研究的ADC药物。2020年8月27日,国家药监局已正式受理该药用于治疗局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的新药上市申请,并纳入优先审评审批程序,受理号:CXSS2000044国。此外,维迪西妥单抗(RC48)还于2020年9月获美国FDA突破性疗法认定用于治疗尿路上皮癌。
东曜药业TAA013
TAA013是由东曜药业研发的一种含有曲妥珠单抗和美坦新衍生物(曲妥珠-MCC-DM1)的在研ADC药物。该药借助曲妥珠单抗的靶向性,与肿瘤细胞膜上的特异性抗原结合,诱发胞吞作用,使高活性细胞毒性药物DM1进入细胞,进而诱发细胞凋亡,用于治疗HER2阳性乳腺癌患者。
目前TAA013 III期临床研究正在进行中,这是一项多中心、随机、平行对照、开放标签研究,针对经曲妥珠单抗治疗失败的、不可切除的局部晚期或转移性HER2阳性乳腺癌患者,对比拉帕替尼联合卡培他滨的有效性和安全性,从而进一步验证TAA013的有效性和安全性。
百奥泰 BAT8001
BAT8001是百奥泰自主开发的一款靶向HER2的ADC药物。该药由抗 HER2 单克隆抗体通过稳定的硫醚键与毒素-连接子 Batansine(一种美登素衍生物)进行共价连接而成。BAT8001 结合到 HER2 受体的第Ⅳ小区后, 开始以受体介导进行细胞内化,之后的溶酶体降解过程导致在细胞内释放含有半胱氨酸-Batansine 的细胞毒性代谢物。 半胱氨酸-Batansine 结合到微管蛋白的过程会破坏细胞内的微管网络,引起细胞周期阻滞与细胞凋亡。
2021年2月8日晚间,百奥泰生物制药股份有限公司(简称“百奥泰”或“公司”)披露抗肿瘤新药BAT8001临床试验进展,BAT8001三期临床主要疗效指标无进展生存期(PFS)与阳性对照组拉帕替尼联合卡培他滨比较未达到预设的优效目标,公司决定终止该项目的临床试验,该项目累计研发投入2.26亿元已计入损益。此外,今年3月初,百奥泰宣布放弃其ADC药物BAT8003和单抗BAT1306的临床开发。据百奥泰公布的2020年报计算,三款药物让百奥泰损失研发投入费用3.4亿元。
恒瑞医药 SHR-A1811
恒瑞医药作为国内创新药研发龙头企业,在 ADC 领域也有很深的布局。目前公司靶向 c-MET 的 ADC 药物 SHR-A1403,以及靶向 HER2 的 SHR-A1201 和 SHR-A1811 都处于临床阶段。今年1月,恒瑞医药第四款ADC药物SHR-A1904的临床实验申请也获得NMPA受理。
注射用SHR-A1811是恒瑞医药自主研发的以HER2为靶点的抗体药物偶联物(ADC),它可与HER2表达细胞的细胞膜表面相结合,然后内吞入细胞到达溶酶体释放小分子毒素,最终诱导肿瘤细胞凋亡,兼具了抗体的高度靶向性以及细胞毒药物对靶细胞的强大杀伤力。
科伦药业 SKB264
2020年4月8日,CDE 官网显示,四川科伦博泰生物医药股份有限公司的 1 类新药注射用 SKB264获临床默示许可,拟用于实体瘤的治疗。注射用 SKB264是靶向人滋养层细胞表面抗原 2(TROP-2)的 ADC 药物,在多种上皮来源肿瘤中高表达,其偶联方式和毒素小分子具有自主知识产权,拟用于恶性肿瘤治疗。注射用 SKB264通过新型偶联方式实现高毒素负载,工艺稳定可控、易于放大,产品批间一致性好。今年8月23日,科伦药业控股子公司KLUS PHARMA INC收到FDA签发的书面通知,允许其“注射用SKB264”抗体偶联药物(ADC)在美开展临床试验。截至目前科伦药业在该药上已投入约2500万元研发费用。
此外,科伦药业ADC药物还有靶向HER2的A166,已向 CDE 提交关键Ⅱ期申请;靶向Claudin 18.2的ADC药物将在2021年进入临床。
石药集团 SYS1801
石药集团自主研发的Claudin 18.2靶向ADC药物SYS1801是国内药企首个Claudin 18.2靶向的ADC药物,2020年11月26日,该药用于治疗胃癌(包括胃食管交界处癌)的适应症获得FDA 孤儿药资格认定。石药集团也计划今年递交中国、美国的临床试验申请。
此外,2019年7月25日,石药集团重组人源化抗HER2单抗-MMAE偶联药物注射液(DP303c)获批临床,适应症为:晚期Her2阳性乳腺癌。
美雅珂生物 MRG003
该公司目前有三个自主研发的创新ADC药物MRG003、MRG002、MRG001已获得NMPA的临床批件,三个I期临床研究正在进行中。
多禧生物 DX126-262
该公司研发的新一代ADC药物DX126-262(DAC-001)已获得国家药监局的临床试验 批件,治疗Her2乳腺癌、胃癌。美国临床申报正在进行中。
浙江特瑞思 TRS005
特瑞思自主研发的ADC药物TRS005用于复发难治型非霍奇金氏淋巴瘤,2018年5月,注射用TRS005获得临床批件,并已启动Ⅰ期临床研究。拟用于复发难治型非霍奇金氏淋巴瘤。
TRS005为国家1类创新药物,该品种已获国家十二五、十三五“重大新药创制”专项滚动支持,并已申请三项中国专利和一项PCT国际专利。TRS005在临床前动物肿瘤模型中展现了十分出色的肿瘤 抑制作用,疗效是重磅级单抗药物 的8倍以上,同时在相对剂量使用上拥有较好的安全性,极具应用前景。
无论国内还是国外,ADC药物研发赛道火热,其市场空间庞大。据中金公司发布的研究报告,整个ADC药物市场有望超过500亿美元。谁能在这一赛道拔得头筹,拭目以待。