与Keytruda对比失败,默克终止PD-L1/TGFβ双抗肺癌三期临床
近日,默克宣布终止PD-L1/TGFβ双抗Bintrafusp alfa的肺癌三期临床。
2019年2月,GSK与默克就Bintrafusp alfa达成全球开发和商业化推广合作协议,根据协议,默克集团将获得3亿欧元(3.4亿美元)的预付款,并有资格获得Bintrafusp alfa肺癌项目高达5亿欧元(5.66亿美元)的拨款。此外,默克还能从葛兰素史克获得高达29亿欧元(33亿美元)的资金支持,两家公司将共同进行新技术的开发和商业化,合作项目的所得利润和成本将平等分摊。
据了解,Bintrafusp alfa是一种双特异性抗体,该抗体可以同时与靶细胞和功能细胞进行相互作用,介导一系列免疫反应。与普通的抗体相比,双特异性抗体增加了一个特异性抗原结合位点,在治疗方面具备显着优势,可以同时阻断两个病理发生的通路,实现许多单抗药物或联合用药不能兼具的疾病治疗作用。
据了解,此次终止的三期临床试验名为INTR@PID Lung 037,该试验旨在评估bintrafusp alfa一线治疗PD-L1呈高表达的IV期非小细胞肺癌(NSCLC)患者,与默沙东抗PD-1疗法Keytruda进行直接比较,共计招募584例受试者。默克表示,在回顾了NINTR@PID Lung 037研究的全部数据后,独立数据监测委员会于2021年1月19日建议停止这项临床试验,基于这一建议,默克决定终止该项研究,因为该研究不太可能达到共同主要终点,特别是无进展生存期。目前,INTR@PID综合临床研究的其他项目试验正在进行中,涉及胆管癌、宫颈癌等。
图片来源:医药笔记
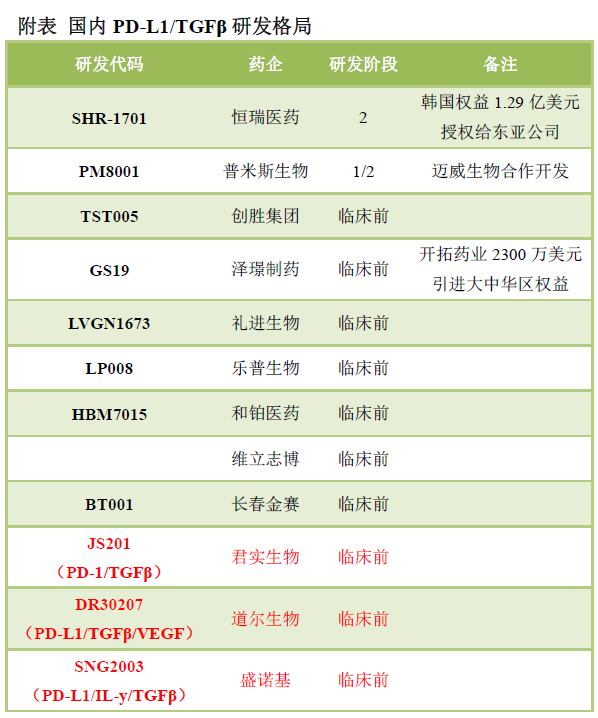
据了解,PD-L1/TGFβ已成为比较热门的跟踪研发双抗之一,包括恒瑞医药、普米斯生物产品已进入临床,其中,恒瑞医药SHR-1701进展较快,2020年4月,恒瑞医药宣布SHR-1701已进入临床I期试验,是国内首个进入临床的PD-L1/TGFβ双特异性抗体,另外,还有一些双抗差异化产品,如君实生物开发了PD-1/TGFβ双抗JS201、道尔生物开发了PD-L1/TGFβ/VEGF三抗、盛诺基开发了PD-L1/IL-y/TGFβ三抗。