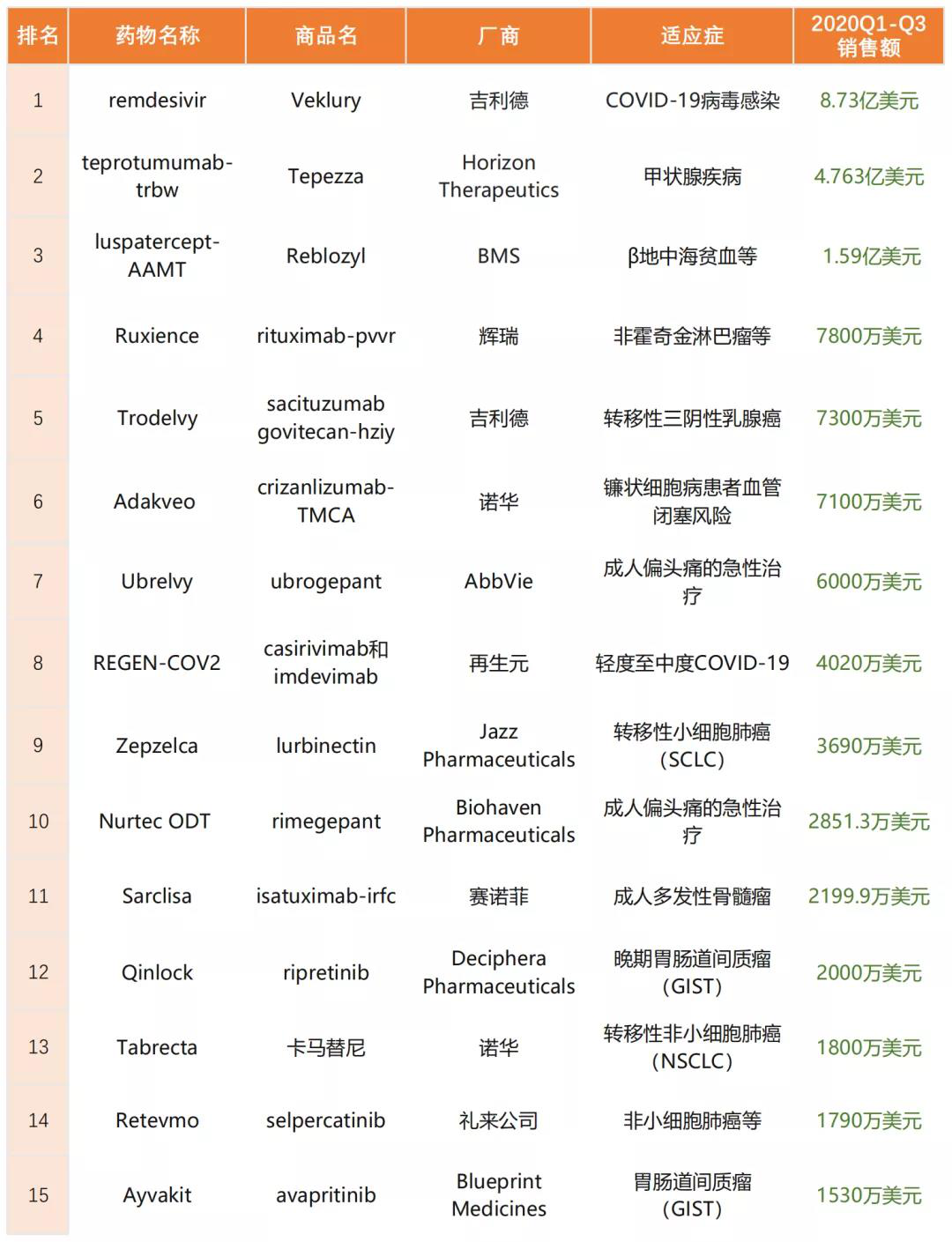
2020畅销药TOP15盘点
日前,生物技术领域影响力杂志GEN评选出了2020年获批上市的最畅销的药物TOP15。这份榜单的排名基于全球跨国药企2020年前三个季度披露的销售数据,其中瑞德西韦以8.73亿美元的销售额拿下榜单TOP1。
(图片来源:思齐俱乐部)
1、瑞德西韦(Veklury)
2020年Q1-Q3销售额:8.73亿美元
FDA批准日期:2020年10月22日(商业化销售始于2020年7月)
所属公司:吉利德
瑞德西韦是目前美国唯一一款获得FDA批准的COVID-19疗法,用于12岁及以上、体重至少40公斤的需要住院治疗的成人和儿童COVID-19治疗。据此前6月吉利德公布的瑞德西韦在美国等发达国家的售价,针对国家和保险类型不同,瑞德西韦一个疗程的售价在2340美元(约合人民币1.6万元)到3120美元(约合人民币2.1万元)之间。
2020年10月,吉利德公布了其2020年第三季度报,营收共计65亿美元,其中瑞德西韦取得了8.73亿美元销售收入。财报显示,瑞德西韦在美国的销售额为7.85亿美元,前三季度在欧盟销售额为0.6亿美元,其他市场销售额为0.28亿美元,即美国的销售额占全球销售额的近90%。有机构预测,该药物在2021年的峰值销售额为30.74亿美元,此后销售额将在2026年降至17.29亿美元。
此外,今年5月和7月,瑞德西韦分别在日本和欧盟获批用于治疗新冠病毒感染患者。
2、Tepezza
2020年Q1-Q3销售额:4.76亿美元
FDA批准日期:2020年1月21日
所属公司:Horizon Therapeutics
Tepezza是一种靶向作用于胰岛素样生长因子-1受体(IGF-1R)的全人单克隆抗体,最初由Genmab和罗氏共同开发,2012年River Vision Development 获得该药的研发和商业化授权,2017年Horizon以1.45亿美元收购River Vision Development并继续该药的开发,2020年1月FDA批准该药上市,目前Tepezza是全球首个且唯一一个甲状腺眼病(TED)治疗药物。
根据E药经理人的报道,Tepezza标价在1.49万美元/瓶左右,给药方式为静脉注射用冻干粉末,每瓶含有500 mg,剂量为起始剂量10 mg/kg静脉输注,之后每3周静脉输注20 mg/kg,额外输注7次,总治疗费用约为12万美元。此前的临床试验结果表明,在完成药物治疗后,患者表现出持久缓解,持续长达一年。
据EvaluatePharma预测,该药物在2026年的销售额可达到14亿美元。
3、Reblozyl
2020年Q1-Q3销售额:1.59亿美元
FDA批准日期:2019年11月8日(2020年进行商业化)
所属公司:BMS及Acceleron
Reblozyl通过调节红细胞成熟后期阶段来帮助患者减少红细胞输注负担,于2019年11月首次获批,用于需要定期输注红细胞的β地中海贫血成人患者,成为首个获FDA批准治疗β地中海贫血相关贫血的药物,同时是首个也是唯一一个获得FDA批准的红细胞成熟剂。
Reblozyl为售价3441美元/瓶,使用剂量为患者1千克体重需要1毫克药物。2020年4月,华尔街著名投资银行Jefferies分析师指出,如果骨髓增生异常综合症(MDS)也获得FDA批准,Reblozyl的年销售峰值将达到20亿美元。
2020年6月,FDA批准Reblozyl用于成人患者治疗β地中海贫血(β-thalassemia)和骨髓增生异常综合症(MDS)相关的贫血。Reblozyl的销售收入也随着适应症增加,2020年上半年Reblozyl的销售收入为0.63亿美元,但到了Q3报,其前三季度的总销售额已达到1.59亿美元。
4、Ruxience
2020年Q1-Q3销售额:7800万美元
FDA批准日期:2019年7月23日(2020年进行商业化)
所属公司:辉瑞普强
Ruxience是美罗华(Rituxan)的一种单克隆抗体(mAb)生物类似药,其作用原理是靶向结合B 细胞表面的CD20蛋白,帮助破坏B细胞,可用于治疗非霍奇金淋巴瘤(NHL)、慢性淋巴细胞性白血病(CLL)、肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)成年患者。
根据E药经理人的报道,Ruxience每10mg的批发商采购价格为71.68美元,相当于美罗华的批发商采购价格提供了24%的折扣。辉瑞表示,该仿制药将以目前已上市产品的批发商采购价格供货,与品牌药相比将提供大幅折扣。
目前,已有多款利妥昔单抗生物类似药上市,包括Celltrion的Truxima、诺华的Rixathon/Riximyo以及辉瑞的Ruxience。同时,国内复宏汉霖的首个国产利妥昔单抗生物类似药汉利康于2020年4月获批上市,信达生物的达伯华于2020年9月获批上市,其他申报利妥昔单抗类似药的企业也已达十多家,而由于这些仿制药的出现,Evaluate Pharma预计到2026年,原研美罗华的销售额可能会猛跌至18.4亿美元。
5、Trodelvy
2020年Q1-Q3销售额:7300万美元
FDA批准日期:2020年4月22日
所属公司:吉利德
Trodelvy为靶向Trop-2(人滋养层细胞表面抗原2)的抗体偶联(ADC)药物,也是FDA批准的首个治疗三阴乳腺癌的ADC药物,原本由Immunomedics开发,2020年9月吉利德以210亿美元收购Immunomedics,将Trodelvy收入囊中。据预测,到2024年Trodelvy全球销售额可达到14.4亿美元。
2019年4月,云顶新耀以一次性首付款6500万美元以及1.8亿美元临床里程碑付款和5.3亿美元的商业化里程碑付款引进该药。同时,目前国内多家企业已在跟进Trop-2靶标的研发工作,包括百奥泰、科伦药业、多禧生物等。
6、Adakveo
2020年Q1-Q3销售额:7100万美元
FDA批准日期:2019年11月15日(2020年进行商业化)
所属公司:诺华
Adakveo是一款靶向P选择素(P-selectin)的单克隆抗体,2019年11月获批用于在16岁以上镰状细胞贫血症(SCD)患者中降低血管阻塞危机(vaso-occlusive crisis, VOC)的发生频率。这是FDA批准治疗VOC的首款靶向疗法,此前还曾获得FDA颁发的突破性疗法认定、孤儿药资格和优先审评资格。
根据E药经理人的报道,诺华公布的批发商采购价格为每支2357美元,患者每个月用3-4支,费用为7071-9428美元左右,每年使用的费用约为85000美元~113000美元。
7、Ubrelvy
2020年Q1-Q3销售额:6000万美元
FDA批准日期:2019年12月23日(2020年进行商业化)
所属公司:艾伯维
Ubrelvy是首个也是唯一一个被FDA批准用于治疗偏头痛发作的口服降钙素基因相关肽(CGRP)受体拮抗剂,通过阻断CGRP与其受体的结合,以一种新的方式发挥作用,并且不会收缩血管也没有成瘾潜力。该药被批准2种剂量强度,50mg和100mg,以便医疗保健提供者能够为患者提供个体化的治疗。
8、REGEN-COV2
2020年Q1-Q3销售额:4020万美元
FDA批准日期:2020年11月21日
所属公司:再生元
REGN-COV2再生元研发,是由2种抗体(casirivimab 和 imdevimab)组成的鸡尾酒疗法,2种抗体分别针对SARS-CoV-2棘突蛋白受体结合区域的2个独立的、不重叠的位点,具有协同作用,可降低病毒变异逃逸的风险。
2020年,FDA批准REGEN-COV2用于治疗最近确诊为轻度至中度COVID-19的高危人群,具体为:新型冠状病毒(SARS-CoV-2)直接检测法结果呈阳性、且有高风险发展为严重COVID-19和/或住院治疗、年龄≥12岁、体重≥40公斤的儿童和成人患者。同时,REGEN-COV2也是美国总统特朗普10月份在治疗COVID-19时接受的3种药物之一。
根据美国政府拨款计划,REGEN-COV2的初始剂量将提供给大约30万例患者,无需自付医药费。
此外,据SVB Leerink预计,Regeneron在2021年的最高销售额约为13亿美元,此后将逐年下降。
9、Zepzelca
2020年Q1-Q3销售额:3690万美元
FDA批准日期:2020年6月15日
所属公司:Jazz Pharmaceuticals
Zepzelca是一种海鞘素衍生物,为RNA聚合酶II的抑制剂,可抑制肿瘤相关巨噬细胞中的致癌转录。Zepzelca原本由PharmaMar研发,2019年12月PharmaMar与Jazz签订了一份总额高达10亿美元的独家许可协议,授予Jazz在美国市场商业化Zepzelca的权利。
2020年6月,FDA通过加速审批通道批准了Zepzelca用于治疗铂类药物化疗后疾病进展的转移性小细胞肺癌。在国内,绿叶制药与PharmaMar签订协议获得Zepzelca在中国的独家开发及商业化权利,包括小细胞肺癌在内的所有适应证。
此外,百时美施贵宝和默沙东的2款PD-1肿瘤免疫疗法Opdivo和Keytruda此前也分别获得批准,用于治疗接受含铂化疗和至少一种其他疗法后病情进展的小细胞肺癌患者。
10、Nurtec ODT
2020年Q1-Q3销售额:2581.3万美元
FDA批准日期:2020年2月27日
所属公司:Biohaven Pharmaceuticals
Nurtec ODT于2020年2月获得FDA批准用于成人偏头痛(有或无先兆)急性治疗,成为首个也是唯一一个获FDA批准的速效口腔崩解片(ODT)剂型的降钙素基因相关肽(CGRP)受体拮抗剂。Nurtec ODT可在口腔内立即分散且不需要水,服用方便。临床试验数据表明,一片Nurtec ODT能让患者在1小时内恢复正常功能。
截至目前,已有4款以CGRP及其受体为靶点的单抗类偏头痛疗法上市,包括安进/诺华Aimovig(靶向CGRP受体)、梯瓦Ajovy(靶向CGRP)、礼来Emgality(靶向CGRP)、灵北Vyepti(靶向CGRP)。
11、Sarclisa
2020年Q1-Q3销售额:1800万欧元
FDA批准日期:2020年3月2日
所属公司:赛诺菲
Sarclisa是一种CD38单克隆抗体,可诱导肿瘤细胞程序性凋亡和调节免疫活性。
2020年3月2日,FDA批准Sarclisa联合泊马度胺和地塞米松(pom-dex),用于既往已接受过至少2种疗法(包括来那度胺和一种蛋白酶体抑制剂)的复发难治性多发性骨髓瘤(RRMM)成人患者。
据相关资料显示,Sarclisa在美国的定价为:100mg/小瓶650美元,500mg/小瓶3250美元。
Sarclisa上市后将成为强生重磅CD38靶向药物Darzalex的第一个直接竞争对手。Darzalex于2015年上市,2019年全球销售额达到29.98亿美元。华尔街投资银行Jefferies分析师预计,Sarclisa上市后的年销售峰值将突破10亿美元。
12、Qinlock
2020年Q1-Q3销售额:2000万美元
FDA批准日期:2020年5月15日
所属公司:Deciphera Pharmaceuticals
Qinlock是广谱KIT和PDGFRα抑制剂,2020年5月FDA批准Qinlock片剂上市治疗已经接受过3种以上蛋白激酶抑制剂疗法的晚期胃肠道间质瘤(GIST) 成年患者,Qinlock成为首个被批准用于四线治疗GIST的新药。
2019年6月,再鼎医药与Deciphera签署协议,获得了Qinlock在大中华区(中国大陆、香港、澳门和台湾)开发和推广的独家许可。Deciphera公司将获得2000万美元的现金预付款,并有资格获得最高达1.85亿美元的潜在开发和商业里程碑付款。此外,再鼎医药将根据Qinlock在大中华区的年度净销售额向Deciphera支付特许权使用费。
2020年7月,国家药品监督管理局正式受理再鼎医药该药物用于胃肠间质瘤(GIST)四线治疗的中国新药上市申请。2020年8月,国家药品监督管理局授予该药针对接受过≥3线治疗的晚期GIST成人患者上市申请的优先审评资格。
13、Tabrecta
2020年Q1-Q3销售额:1800万美元
FDA批准日期:2020年5月6日
所属公司:诺华
Tabrecta是一种口服MET抑制剂,由诺华于2009年从Incyte公司授权获得。2020年5月FDA批准用于治疗携带MET外显子14跳跃(MET exon14 skipping,METex14)突变的转移性非小细胞肺癌(NSCLC)成人患者,包括一线治疗(初治)患者和先前接受过治疗(经治)的患者。Tabrecta成为全球第一个也是唯一一个被FDA批准专门针对METex14突变转移性NSCLC疗法,其推荐剂量为每日两次口服400mg。
此外,全球获批的首款MET抑制剂为默克公司的Tepmetko(tepotinib),于2020年3月26在日本获批上市。
14、Retevmo
2020年Q1-Q3销售额:1790万美元
FDA批准日期:2020年5月8日
所属公司:礼来
Retevmo是一种口服选择性RET激酶抑制剂,能够阻断RET激酶,并阻止癌细胞生长,不过该药也可能影响健康细胞从而产生副作用。
2020年5月,FDA批准Retevmo上市用于治疗肿瘤特定基因(转染期间重排基因,RET基因)存在基因改变(突变或融合)的3种类型肿瘤患者,包括非小细胞肺癌、甲状腺髓样癌以及RET融合阳性的甲状腺癌。Retevmo成为首个被批准专门用于携带RET基因改变的癌症患者的治疗药物。
Retevmo的推荐剂量为120mg或160mg(根据体重而定),每日服用2次,直至疾病恶化或出现不可接受的毒性。
15、Ayvakit
2020年Q1-Q3销售额:1530万美元
FDA批准日期:2020年1月9日
所属公司:Blueprint Medicines
Ayvakit是一款强力的高特异性KIT和PDGFRA突变激酶抑制剂,2020年1月FDA批准Ayvakit上市治疗无法切除或转移性胃肠道间质瘤(GIST)成人患者。同时Ayvakit也是第一个被批准用于GIST的精准疗法,以及唯一一个对PDGFRA基因18号外显子突变型GIST具有高活性的药物。
2020年12月,Blueprint Medicines向FDA提交了Ayvakit用于治疗晚期系统性肥大细胞增多症(SM)的补充新药申请(sNDA)。
国内,基石药业与Blueprint Medicines达成独家合作及授权协议,获得了包括Ayvakit在中国大陆、香港、澳门及台湾的开发与商业化权利。Blueprint Medicines保留在世界其他地区开发及商业化这三款候选药物的权利。
此外,据悉在美国,30天用量的Ayvakit费用约为3.2万美元。