外媒评出的全球最关注十大中国生物科技企业
在人才、政策、资本的多重助推下,中国生物医药产业近几年进入了前所未有的蓬勃发展期,药物研发已不再仅满足Me-too、Me-better,而是开始致力于将First-in-Class的产品带给全球的患者。去年11月,百济神州的泽布替尼获得美国FDA批准上市,实现了中国本土抗癌新药“出海”零突破就是最好例证之一。
据麦肯锡报告显示,中国对全球医药研发的贡献率于2018年上升至4%-8%,已跨入第二梯队,具体而言,中国在pipeline(上市研发前的产品数量占全球的比例)和上市后的新药数量占全球的比例贡献率已分别达到7.8%和4.6%,而在2016年,这两个数据分别是4.1%和2.5%。
这类比例上升的背后,是中国有越来越多的新药获批上市,GBI Health数据显示,2016年中国获批生物新药仅为7种,2017年获批了42种,而2018年和2019年这一数字已上升到60种和57种。
与之相应的是,中国本土正在逐步成长起一批生物科技企业,近日,世界知名网站FiercePharma评选出了全球最关注的十大中国生物科技企业,这十大企业主要集中在肿瘤和心血管创新药领域,高管和科研负责人大多有海外背景,有些曾经是全球领先制药企业总部高管;公司有海外投资,有些甚至布局了从研发到商业的完整海外产业链,建立了丰富的产品管线,已有产品实现商业化,或即将上市首款新药,是这些公司的共同特点。
FiercePharma指出,这十大公司脱颖而出的原因是,除了一家以外,所有公司都吸引到了全球顶级制药企业购买其自主研发的产品。比如,例如百济神州已经与安进签约,和黄医药与礼来、阿斯利康持续合作,基石药业则将其PD-L1抑制剂在中国的商业化权利出售给了辉瑞。
不过,FiercePharma也认为,中国创新药市场并不缺钱,缺的是真正的创新,即使在现阶段,大多数中国制药公司仍然做得是“me-to”或“me-better”的产品,其遵循着已经验证过的机制,因此很少能与美国等西方制药公司同台竞争,这就是为什么中国生物技术的繁荣至今仍是一种“国内狂欢”,而无法成为全球性事件。当然,中国的生物技术产业还很年轻,需要时间成长。从长期来看,无论从声誉角度还是从业务可持续性角度考虑,内部研发能力都非常最重要。
在中国生物技术公司的特点上,FiercePharma总结道:与美国在治疗上更具多样性的研究格局不同,肿瘤是目前中国生物技术公司的关注重点,此次评选出的10家公司中只有一家不是为肿瘤药物研发而创建,事实上,中国的心血管和代谢疾病普遍存在,但生物技术公司似乎对其缺乏重视,下面就具体分析一下这10家生物技术公司的特点:
百济神州
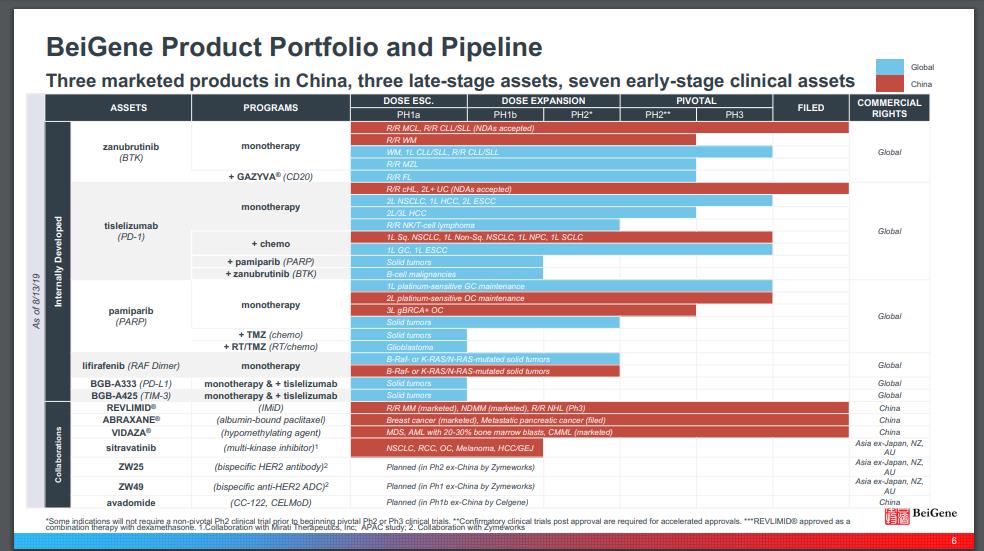
百济神州已建立十年,其从一家初创型公司逐渐成长为一家创新药明星公司,根据EndpointsNews发布的全球药企市值排行榜,百济神州已跻身全球前50强药企之列。目前,百济神州在中国大陆、美国、澳大利亚和欧洲有4700多名员工,并相继完成了8轮融资。
从成立至今,百济神州建立了丰富的产品管线,其中,已有两款产品实现商业化,即PD-1药物百泽安(替雷利珠单抗)和BTK抑制剂百悦泽(泽布替尼),根据百济神州第三季度报,这两款药物分别取得4994万美元和1566万美元的收入,同时,百济神州第三款自主研发的抗癌新药PARP1/2抑制剂帕米帕利的新药上市申请也于今年7月获得中国药监局受理,有望成为其第三款走入市场的抗肿瘤新药。
此外,百济神州的的产品管线中还有25款早期临床药物,其中包括抗肿瘤药物TIGIT、Bcl-2、OX40T,首创新药潜力的研究项目HPK1等8个拥有全球权益的药物,并在全球开展超70项临床研究,包括27项注册性临床试验,是目前中国开展全球临床试验最多的药企。
由此,在药品研发投入,百济神州也走在了最前列,2016年-2020年前三季度,百济神州研发投入分别为6910万美元、2.69亿美元、6.79亿美元、9.27亿美元、9.4已美元,累计达到近29亿美元,合人民币近190亿元,仅是去年全年和今年前三季度的研发投入,百济神州就远超“医药一哥”恒瑞医药数十亿元。
FiercePharma认为,百济神州基本上称得上是中国蓬勃发展的生物技术产业的发源地。
近日,百济神州还发布公告称公司拟科创板上市,预计将于2021年上半年完成。若成功在科创板上市,百济神州将成为第一家在美股、港股和A股同时上市的本土创新药企。
和黄医药
和黄医药的公司架构与其他生物技术公司稍显不同。该公司最初由和记黄埔开发的“商业平台”起步,与几家中国老牌制药公司合资,专注于处方药和消费保健品,以及为第三方提供分销和营销服务,产品主要是由其合资伙伴出资或代表其他公司销售。此后在辉瑞老将苏慰国博士等的领导下,该公司内部“创新平台”才被建立称为和记黄埔医药。
2018年,和黄医药VEGFR抑制剂Elunate(fruquintinib,呋喹替尼)获得中国药监部门批准,用于治疗至少经历两次治疗失败的结直肠癌患者。这是该公司的第一个创新药物,也是第一个完全在中国进行研发和商业化肿瘤药物。
2019年11月,呋喹替尼被纳入国家医保目录,价格下调至1984.5元/盒(1mg x21规格)和2646元/盒(5mg x7规格),降幅超60%,另据和黄中国财务数据,在2019年,约有3000例患者接受了呋喹替尼的治疗,其2019年销售额为1760万美元。
FiercePharma认为,和黄医药的进一步突破将聚焦在两款已经到研发后期的药物。
一款是surufatinib(索凡替尼),其是一种新型的口服酪氨酸激酶抑制剂,具有抗血管生成和免疫调节双重活性,可通过抑制血管内皮生长因子受体(VEGFR)和成纤维细胞,去年11月,中国药监部门已受理其用于治疗晚期非胰腺神经内分泌瘤的上市申请。
另一款是MET抑制剂savolitinib(沃利替尼),是国家首创治疗MET罕见突变肺癌的新药,实现了在MET罕见突变肺癌的突破,其新药上市申请已被药监局纳入纳入优先审评。
基石药业
基石药业成立仅五年的时间,但已取得多项显着成绩,包括成立三年就登陆港交所,2018年完成2.6亿美元B轮融资,是当时中国生物技术公司金额最大的B轮融资,也进入了当年全球十大融资记记录。
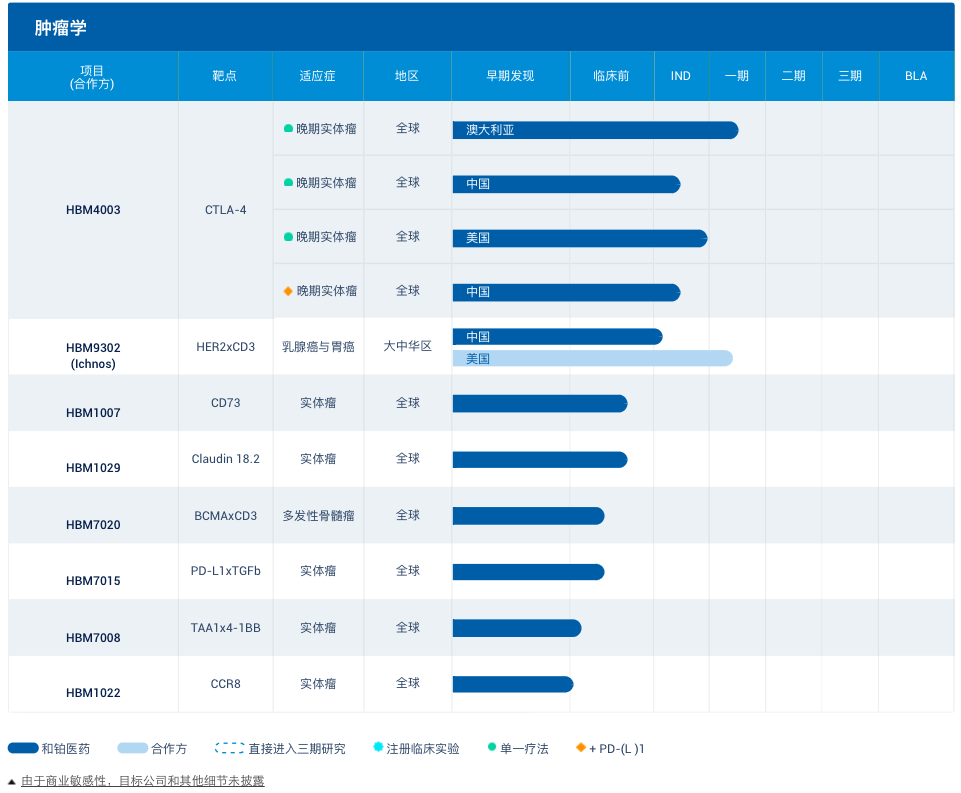
作为一家以肿瘤免疫治疗联合疗法为核心生物技术公司,基石药业建立了一条15种肿瘤候选药物组成的丰富产品管线,其中5款后期候选药物正处于关键性临床试验或注册阶段。
今年10月,辉瑞以总价约2亿美元认购基石药业的新发股份,辉瑞以此获得了获得舒格利单抗在中国大陆地区的独家商业化权利,该产品是基石药业开发的PD-L1单克隆抗体,是一款处于后期研发阶段的核心肿瘤产品。
除舒格利单抗外,基石药业预计将在2021年获得三款小分子靶向药的新药上市批准,包括:用于治疗复发性或难治性急性髓性白血病的Ivosidenib(IDH1i)、用于治疗PDGFRA 18外显子胃肠道基质瘤的Avapritinib(KIT/PDGFRAi)和用于治疗二线RET+非小细胞肺癌的Pralsetinib(RETi)。
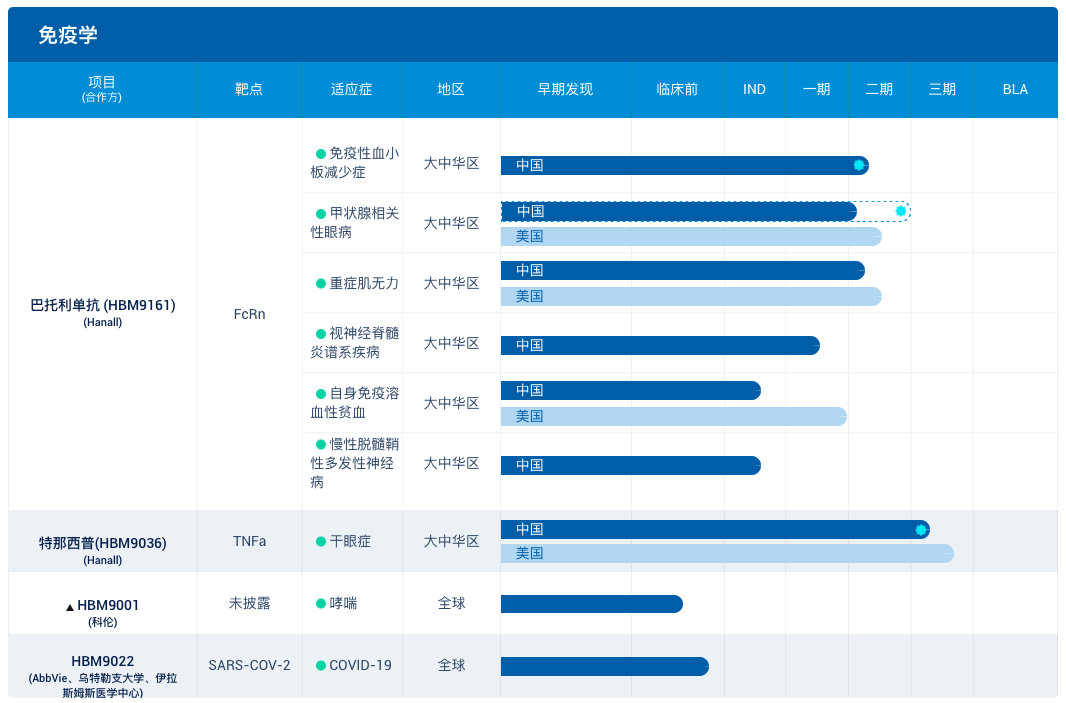
和铂医药
和铂医药创立于2016年末,专注于肿瘤免疫、免疫性疾病等创新药物的研发,目前,其在公司在荷兰鹿特丹,美国波士顿,中国上海、苏州均设有研发基地或运营中心。
成立至今,和铂医药融资超3亿美元,并将在最近寻求通过港交所上市聆讯。
和铂医药拥有全球专利的两个全人源抗体转基因小鼠平台(Harbour Mice),并利用此平台研发针对肿瘤和免疫性疾病的高度差异化抗体疗法,包括全人源抗体药物(H2L2)以及基于重链抗体(HCAb)的双靶点抗体(HBICE)。和铂医药自有的全人源抗体转基因小鼠和单细胞分析技术,能够大大缩短候选药物发现时间,在数天的时间里完成原本需要几个月的抗体产生与发现过程。
据悉,全球已经有30多家制药公司和学术机构采用和铂医药的全人源转基因抗体平台开展抗体新药的开发,其中包括礼来、辉瑞、信达、百济神州、正大天晴等大型药企。
因此和铂医药管线也得以快速拓展,公司管线已覆盖11种靶点,提供同类最佳或同类首创产品的研发。截至2020年6月30日,已有6个项目进入临床阶段。此外,和铂医药还有多款处于早期开发阶段的在研项目,数量大于20个。
华领医药
在中国迅速发展的肿瘤创新药公司中,华领医药是一个罕见的例外,这家公司正在开发治疗糖尿病和中枢神经系统疾病的药物。
华领医药总部位于上海张江高科技园区,于2011年6月成立,由创始人陈力协同生物医药领域企业家以及知名投资机构共同创立,主要致力于糖尿病药物的研发。
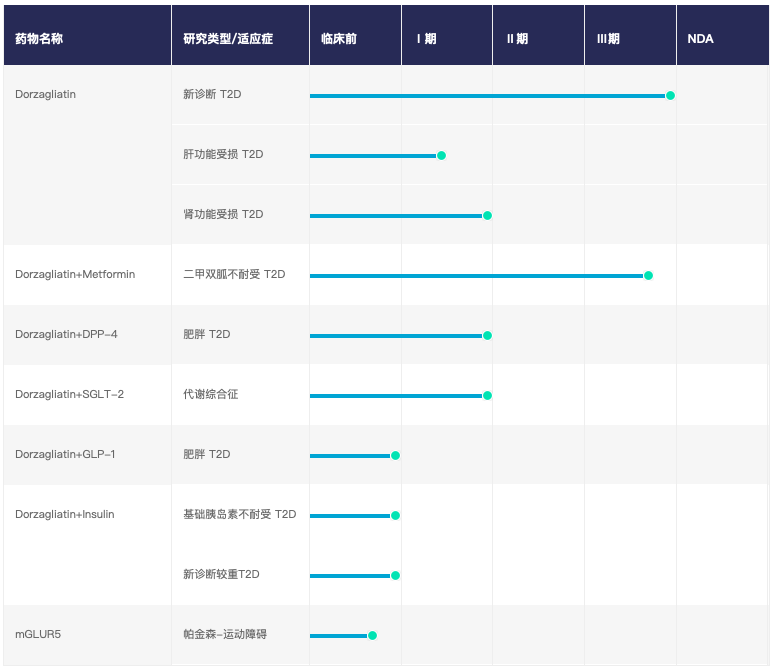
目前,华领医药正专注开发治疗2型糖尿病的全球首创新药口服药物Dorzagliatin,据了解,Dorzagliatin (HMS5552)是针对2型糖尿病的新机制第4代葡萄糖激酶活剂调节剂,可针对人体血糖平衡传感器葡萄糖激酶的功能损伤进行有效治疗。现阶段临床试验初步显示,Dorzagliatin 既作为单药疗法,也可与使用最广泛的口服抗糖尿病药物二甲双胍)合使用,目前,Dorzagliatin正处于临床III期试验阶段,临床试验结果预计于2019年下半年发布,届时华领医药将向国家药监局提交该产品作为一类新药的新药申请(或NDA),并争取在2020年之前取得国家药品监局(或CDA)的批准。
除Dorzagliatin外,华领医药还拥有一种临床前的中枢神经系统药物,名为mGluR5-NAM,其作用靶点是代谢型谷氨酸受体亚型5(mGluR5),一种谷氨酸的传感器,正在针对帕金森病开展研究。
天境生物
天境生物正式成立于2016年,创立历史最早可以追溯到2014年11月成立的“三境生物”,创始人臧敬五曾是前GSK中国区总裁,其是一家临床阶段生物制药公司,聚焦于肿瘤免疫和自身免疫疾病领域内尚未满足的重大治疗需求,专注于开发具有高度差异化特质的创新生物药。在2018年和2019年GEN发布的《2019全球免疫肿瘤学初创公司TOP10》榜单中,天境生物也是唯一一家上榜的中国公司。
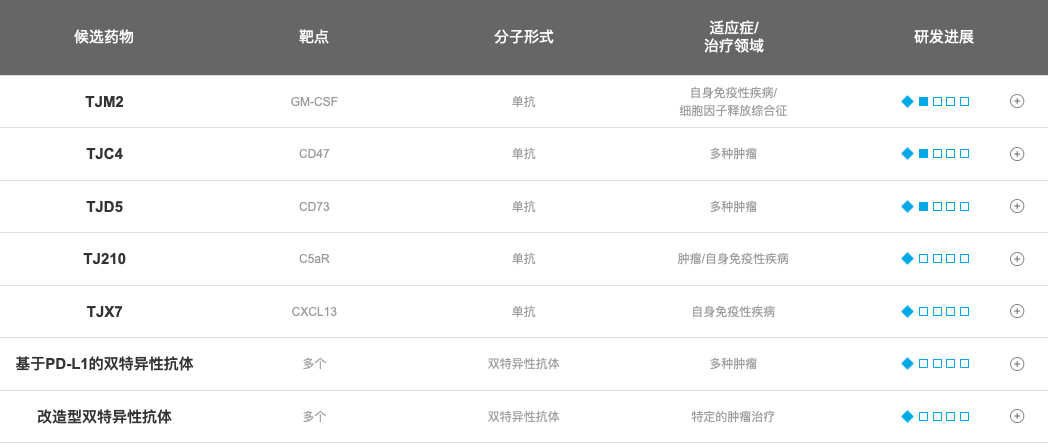
目前,天境生物手握多个重磅产品,其中,TJ202是天境生物的核心产品之一,其是一个具有成为全球范围内 “同类最优” 潜力的靶向CD38的抗体,由天境生物通过许可协议方式从德国MorphoSys获得其在大陆、香港、澳门及台湾地区的独家开发和商业化权益。相较于同类产品,在临床应用上,TJ202有两项关键性的优势,第一,在同样的用药情况下,与地塞米松、抗退热药和抗组胺药相比,TJ202的输注时间明显缩短,输注反应速率降低;第二,与目前已经上市的CD38抗体相比,TJ202不会下调骨髓瘤细胞表面CD38的表达,从而可以长期保持骨髓瘤细胞对TJ202的敏感性,让患者可以长期使用TJ202进行治疗。基于天境生物“快速上市”策略,该药有望于2021-22年获批上市,将向同样是靶向CD38的人源化单克隆抗体Darzalex发起有力的冲击。
今年9月,天境生物就在研抗癌药CD47单克隆抗体lemzoparlimab(TJC4)的开发和商业化达与艾伯维达成全球战略合作,艾伯维将支付首付款和里程碑付款高达19.4亿美元,加上不少于10亿美元的潜在双特异性抗体合作,最高潜在价值可达30亿美元,刷新了中国生物制药企业向海外授权交易的历史最大金额,也是过去五年全球生物科技领域授权交易的最大金额。
最近,lemzoparlimab在美国完成了剂量递增阶段的1/2阶段研究,结果表明该药物耐受性良好,没有出现严重的血液学安全问题。目前该药物已推进到2期研究,与默沙东Keytruda联合用于实体瘤患者,并与罗氏Rituxan联合用于非霍奇金淋巴瘤患者。
信达生物
信达生物成立已有9年的时间,并于2018年在港交所上市。
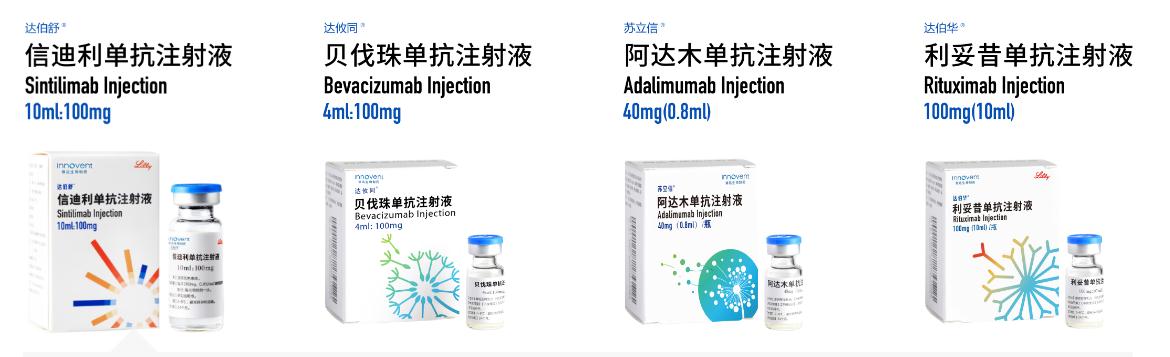
截止目前,信达生物已建立起了一条包括23个新药品种的产品链,覆盖肿瘤、代谢疾病、自身免疫等多个疾病领域,其中有4个产品已获批上市,包括PD-1药物信迪利单抗(商品达伯舒)、贝伐珠单抗(商品名达攸同)、阿达木单抗(商品名苏立信),利妥昔单抗(商品名达伯华)。
在这之中,信迪利单抗是信达生物首个实现商业化的产品,2018年12月,信迪利单抗正式被国家药品监督管理局批准上市,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤,并于2019年进入国家医保目录,成为目前唯一进入医保目录的PD-1产品。根据信达生物财务数据显示,去年信迪利单抗全年销售业绩为10.159亿元,今年前三季度的销售业绩则超15亿元。
目前,信达生物还有4个产品进入III期或关键性临床研究,15个产品已进入或即将进入临床研究。
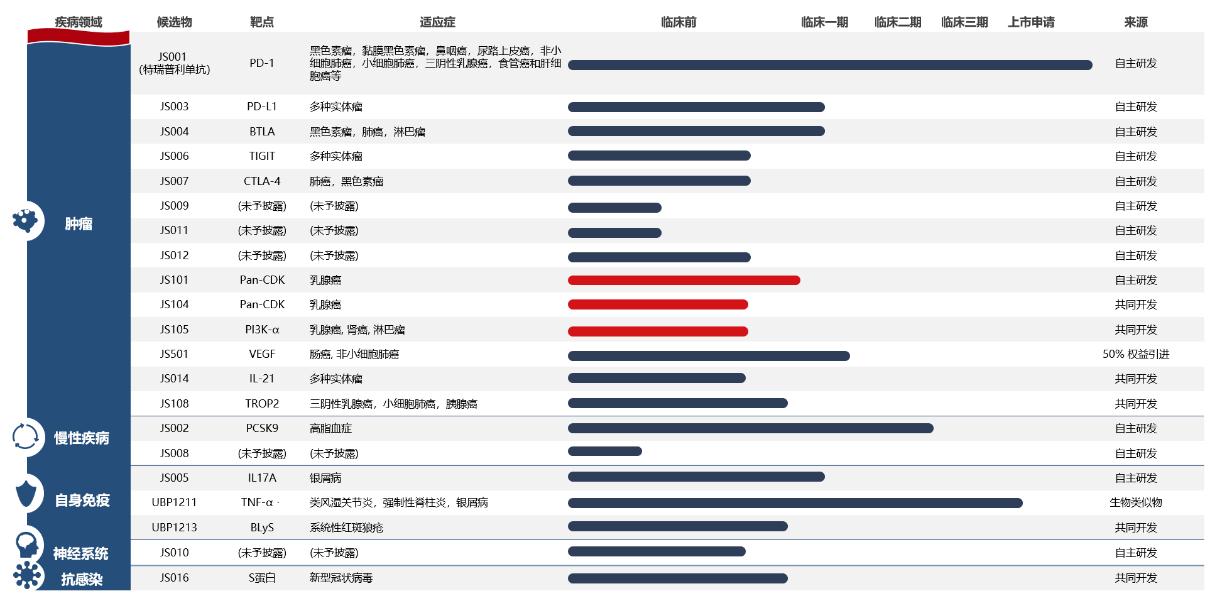
君实生物
君实生物是另一家PD-1抑制剂已上市的中国公司,其特瑞普利单抗(商品名拓益)成为中国首个获批上市的国产PD-1,这是君实生物目前唯一实现商业化的产品,其财务数据显示,特瑞普利单抗去年全年销售业绩为7.78亿,今年三个季度累计实现销售收入超8亿元。
今年9月,特瑞普利单抗注射液用于鼻咽癌的治疗获得美国FDA突破性疗法认定,这也是首个获得该突破认定的国产PD-1,这也将加速特瑞普利单抗在美国的商业化开发计划。
在今年新冠疫情期间,君实生物与中国科学院微生物研究所还共同开发了一款重组全人源单克隆中和抗体JS016,以高亲和力特异性结合SARS-CoV-2表面刺突蛋白受体结构域,并能有效阻断病毒与宿主细胞表面受体ACE2的结合。今年10月,君实生物发布公告称,在一项联合疗法中,JS016在降低病毒载量、减轻症状及降低和冠状病毒相关的住院及急诊治疗方面均显示出良好疗效。
除了以上两种药物外,君实生物的内部产品线也在向肿瘤学倾斜,药物靶向PD-L1、BTLA、TIGIT、CTLA-4和CDK,同时还有心血管疾病和自身免疫疾病等候选药物。
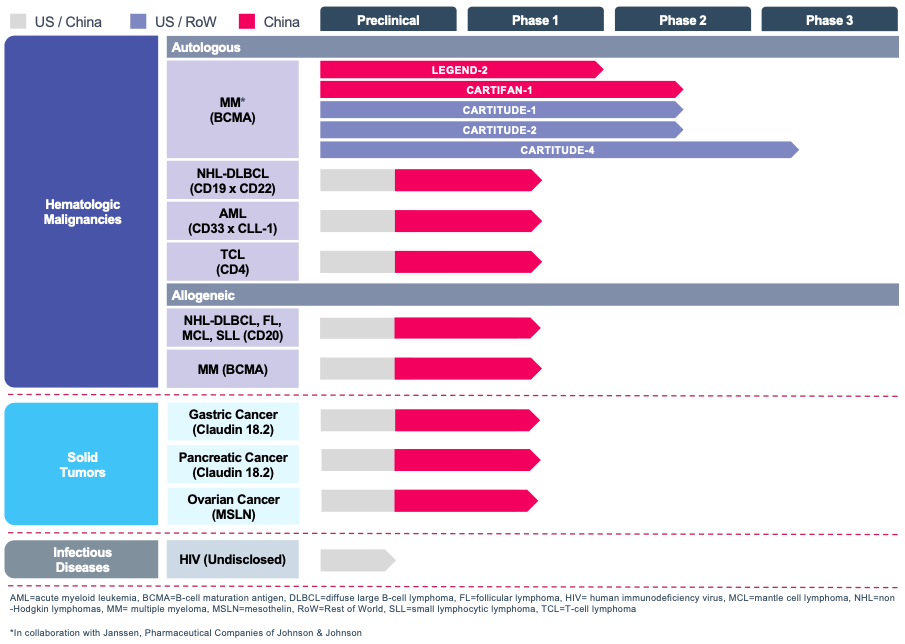
传奇生物
传奇生物成立于2014年,是港股上市公司金斯瑞生物科技(01548)分拆而出,是金斯瑞旗下专攻CAR-T细胞免疫疗法的跨国子公司,2015年5月27日在开曼群岛注册成立为获豁免的公司。
目前传奇生物在细胞治疗领域已布局多条管线,其在中国和美国的临床试验也相继进入临床II、III期阶段,其进展最快的BCMA CAR-T疗法LCAR-B38M / JNJ-4528。
传奇生物的目标是CAR-T和相关细胞疗法在治疗血液恶性肿瘤、实体瘤和传染病方面的研发。在目前商业化较领先的LCAR-B38M / JNJ-4528上,公司计划通过LCAR-B38M /JNJ-4528的推进,获得在全球范围内治疗R/RMM的批准。据CARTITUDE-1的结果,公司预计于2020年下半年向FDA提交JNJ-4528的适用于R/RMM治疗的BLA(生物制品许可申请)。
另外,公司还将寻求LCAR-B38M/JNJ-4528在欧洲、中国、日本获批上市。JNJ-4528临床数据的优异促使传奇生物的商业化脚步不断提速,未来变现能力不容小觑。
再鼎医药
FiercePharma认为,之所以要把再鼎医药列入,主要是因为其创始人兼首席执行官杜莹,她是再鼎医药的灵魂人物,有着很丰富的职业履历,曾在辉瑞工作8年,参与了2个重大新药的研发及成功上市;曾担任红杉资本中国基金医疗健康产业董事总经理,主导投资了贝达药业、喜康寿生物、华大基因和安琪儿医院等项目;曾任和记黄埔医药的创始人兼首席执行官及和黄中国医药科技有限公司的联合创始人兼首席科学官,并在这些公司率将五种内部研发的创新候选药物推至临床试验,包括两种全球III期候选药物。
目前,再鼎医药通过授权引进及内部研发,目前已在肿瘤、抗感染及自体免疫三大疾病领域建立了丰富的产品管线,包括16种具有全球同类最佳/同类首创潜力的产品及候选药物,覆盖了合成致死、肿瘤电场治疗、靶向疗法、免疫肿瘤疗法、小分子、单抗及双特异性抗体等。
其中,有两款产品实现商业化,包括高效、选择性每日一次口服小分子聚(ADP-核糖)PARP1/2抑制剂——则乐(尼拉帕利),其于2020年1月在中国内地正式商业上市,用于对含铂化疗完全或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者维持治疗。此外,今年9月8日,药监局批准了则乐的sNDA,用于对一线铂类化疗完全或部分缓解的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的成年患者的维持治疗。2020年上半年,则乐销售收入为1380万美元。
另外一款获批上市的产品是肿瘤电场治疗产品爱普盾,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤患者,以及作为单一疗法用于复发胶质母细胞瘤患者。成为15年来中国内地首个获批用GBM的疗法,2020年上半年,爱普盾销售收入达542.2万美元。
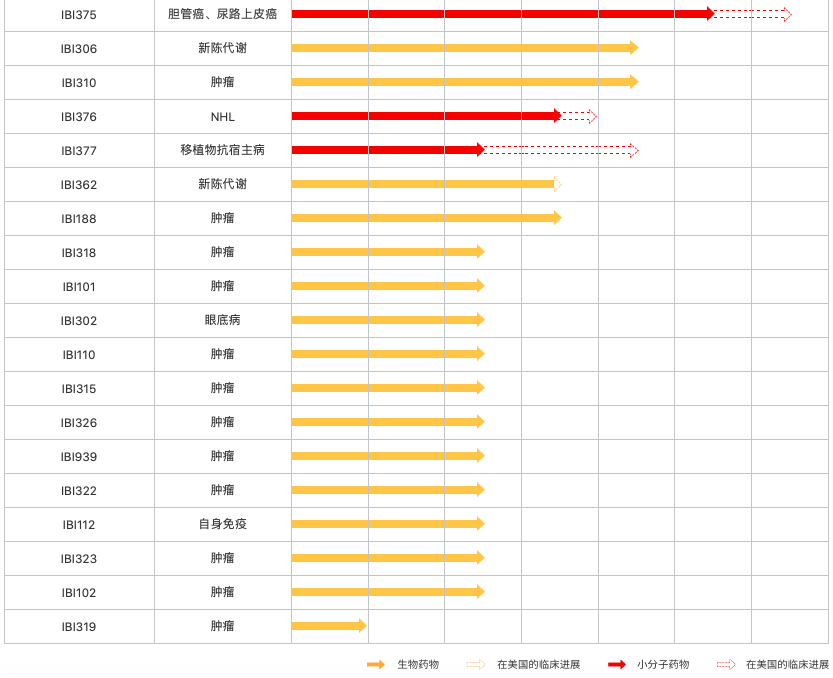
除了上述2款产品,今年,再鼎医药的抗感染新药甲苯磺酸奥玛环素(Omadacycline)和酪氨酸激酶开关控制抑制剂瑞派替尼的中国上市申请获受理并获得了优先评审资格,即将进入收获期。其中甲苯磺酸奥玛环素用于治疗社区获得性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI),瑞派替尼用于治疗已接受过包括伊马替尼在内的3种及以上激酶抑制剂治疗的晚期胃肠道间质瘤(GIST)成人患者,并且已在今年7月成为海南自贸港博鳌乐城首个特批带离药物。