“罕见病药国内一支70万国外41澳元“背后的真相
近日,一则“国内70万元一支的药在澳大利亚仅需41澳元”的消息冲上微博热搜,引发人们的高度关注。
起因与回应
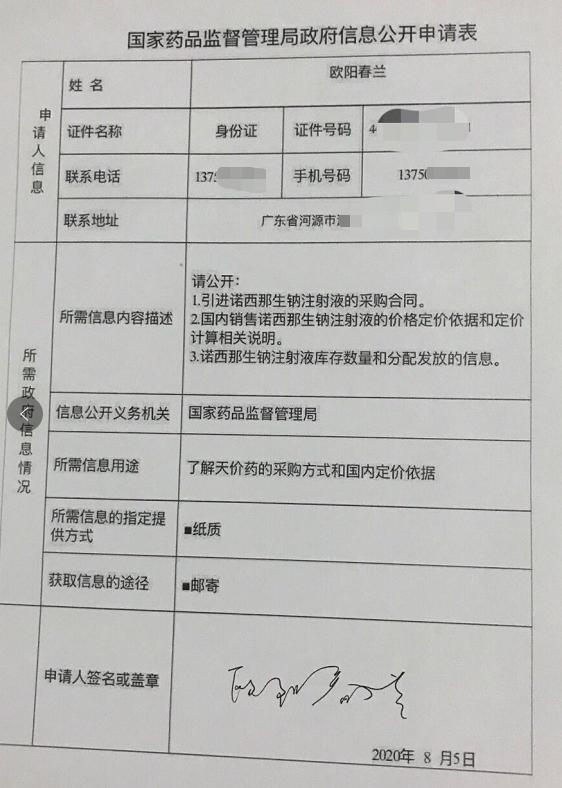
事件的起因为,广东一位母亲欧阳春兰向国家药监局提交信息公开申请,希望了解治疗脊髓性肌肉萎缩症(SMA)药品——诺西那生钠注射液(Spinraza)的采购方式和国内定价依据,病请求公开“引进诺西那生钠注射液的采购合同;国内销售诺西那生钠注射液的价格定价和定价计算相关说明;诺西那生钠注射液库存数量和分配发放的信息。”
据红星新闻报道,欧阳春兰表示,几天前,她看到湖南怀化一位刚满1岁的婴儿生命垂危的“求药”信息,而能救治孩子的药品却非常高昂。
“这个孩子得了SMA,医院推荐了诺西那生钠特效药,但该药一针的价格竟然高达70万元。有网友从澳洲了解到,在当地该药一针价格只需要41澳元。”为确认价格,欧阳春兰于8月5日上午向国家药品监督管理局邮递了信息公开申请书。
日前,医保局已对此作出回应。
8月5日,国家医保局信访办一工作人员在接受媒体采访时表示,诺西那生钠注射液的价格是由药企自行定价,所以该药在每个国家的价格存在一定出入,“除了药物的原材料、研发成本等,药企业也会考虑利润问题,加上该药物目前在国内处于市场垄断的情况,价格也一直居高不下。”
该工作人员表示,诺西那生钠注射液自2019年在国内上市以来,已被纳入医保谈判日程,国家希望和相关药企业谈判,将药物价格降下来,进而满足SMA患者的需要。“去年开始国家就在和药企谈判,由专家组研究定价,具体定价多少不清楚。但是纳入医保的事没有谈下来,因药物价格下不来,就始终没办法进入到医保目录。”上述工作人员表示。
Spinraza的定价情况
Spinraza是一种反义寡核苷酸药物,由美国渤健公司(Biogen Idec Ltd)研发,用于治疗罕见病脊髓性肌萎缩症(SMA)。
SMA是一遗传性神经肌肉疾病,主要影响肌肉力量和运动,患者主要表现为全身肌肉萎缩无力,身体逐渐丧失各种运动功能,甚至是呼吸和吞咽。SMA是2岁以下婴幼儿群体中的头号遗传病杀手,在新生儿中发病率约为1/6000-1/10000,中国大约有3-5万患儿。根据起病年龄和运动里程的获得情况,SAM分为SMA-I型、II型、III型和IV型,如果不进行治疗,大多数SMA-I型的患儿无法存活到两岁。
一直以来,SMA都无有效治疗药物,全世界范围内对SMA的治疗措施都仅限于呼吸支持、营养支持和骨科矫形等辅助治疗。直到2016年12月,Spinraza获得美国FDA批准,成为首个SMA治疗药物,随后欧盟、巴西、日本、韩国、加拿大等国家也相继批准Spinraza上市。2019年2月,中国国家药监局批准Spinraza上市,用于治疗5q脊髓性肌萎缩症(占所有SMA病例的95%),这也是在中国首个获批治疗SMA的药物。
目前Spinraza在中国的治疗费用一针接近70万一支,患者第一年要打6针,此后每年要打3针进行维持。第一年的治疗费用高达400多万,2019年5月末,Spinraza在全国14个省市范围内开展了援助项目,不过据测算,即使患者参加援助项目,第一年治疗费用也需140万左右,之后每4个月注射1支,平均年花费在105万左右,对于很多中国普通家庭来说,仍是巨额数目。
相较之下,在澳大利亚每支只需要41澳元(约合人民币205元),单支价格差了约3400倍。
不过,乍看令人震惊的药价差距并不是定价造成的,真正的原因在于Spinraza在澳大利亚被纳入了医保。
对此,渤健在其官微特地发布声明称,截至2020年6月30日,诺西那生钠注射液已在全球50个国家和地区获批,并在40多个国家和地区获得了报销,其中就包括澳大利亚。据澳大利亚药品福利计划(The Pharmaceutical Benefit Scheme - PBS)网站的公开信息,诺西那生钠注射液已被纳入药品福利计划,药品的政府采购单支价格为11万澳元,患者自付费用为41澳元,41澳元不是诺西那生钠注射液在澳大利亚的药品销售价格,而是纳入医保报销后的患者自付价格。
事实上,Spinraza在其他国家的定价也并不便宜,比如美国,其一针定价为12.5万美元(约为87万人民币),一年注射5-6针,总费用在62万美元-75万美元之间(约为430-520万人民币),第二年的费用约37.5万美元(约为260万人民币),整体费用更贵。
国内能否入医保?
近年来,我国正在不断加速罕见病药物审批,提高罕见病患者用药保障。2019年,国家医保局在新版医保目录调整方案中就提到优先考虑癌症及罕见病等。2019年通过医保谈判,新版医保目录成功纳入了22款抗癌药,7款罕见病用药,平均降幅超60%。
2018年5月,SMA被纳入国家《第一批罕见病目录》;2018年11月,Spinraza被列入《第一批临床急需境外新药名单》;2019年2月,Spinraza通过优先审评审批程序在中国获批。2019年5月,中国初级卫生保健基金会在Spinraza上市后的3个月,即2019年5月启动了SMA患者援助项目,帮助SMA患者第一年的治疗费用相比全自费节省约2/3,之后每年的治疗费用与全自费相比可节省约一半,援助药物由渤健公司捐赠。截至目前,全国已有80多位SMA患者受益。
不过,Spinraza并未参加2019年的国家医保谈判,因为参加谈判的药品必须是2018年12月31日前获得批准的药品,Spinraza不符合参加2019年国家医保谈判的条件。
渤健方面在声明中明确,公司一直与国家和地方政府相关部门保持积极沟通,呼吁建立多方共付机制,以进一步提升中国SMA患者药物可及性。
另据界面的熬到,诺西那生钠注射液将参与今年下半年进行的医保谈判,目前有关方面正对其进行卫生技术评估,企业方面也有降价意愿。
其他入局者
Spinraza曾是SMA的唯一治疗药物,2018年该药为渤健贡献了17亿美元的销售额,2019年该药的收入比2018年增长22%,达到21亿美元,其中在美国增长9%,至9.33亿美元,在美国以外增长34%,至12亿美元。但现阶段在SMA赛道上,Spinraza有了竞争对手。
自Spinraza上市后,2019年5月,诺华的一次性SMA基因疗法Zolgensma获批上市,一剂210万美元(约合1448万元人民币),被称为有史上最贵药物。不过,不同于Spinraza,Zolgensma单次注射即可完成治疗,并采取灵活的医保支付政策,且可以分5年付清,允许在付清款项前疗效就终止的情况下,支付方可以不需支付剩余费用。2020年3月和5月,Zolgensma分别获得了日本和欧盟的批准。同时,日本厚生劳动省于当年5月将Zolgensma列为公共医疗保险适用对象,未满2岁患者的公共保险医疗费窗口自付比例为2成。
根据诺华近日公布的2020年上半年业绩报告,Zolgensma上半年度实现了3.75亿美元的销售额,其去年获得3.61亿美元的销售业绩,截止目前,Zolgensma已累计获得7.36亿美元的销售业绩,目前Zolgensma暂未在中国上市。
除了Zolgensma,Spinraza还将迎来另外一大竞争对手,即罗氏的SMA口服疗法Risdiplam,这是一种运动神经元生存基因2(SMN2)剪接修饰剂,开发用于所有类型(1型、2型、3型)SMA的治疗,与鞘内注射给药方式相比,口服将会是Risdiplam的一大优势,该药正在接受美国FDA的审查,预计将在今年8月获得审查结果,如若获批上市,其会成为治疗所有类型SMA的首个口服药物。
同时,Risdiplam已在中国递交上市申请,今年6月,国家药品监督管理局正式授予risdiplam 优先审评资格。
相关统计数据显示,全球目前大约有60000例SMA患者,Spinraza覆盖人群大约有11110例,截止Spinraza获批上市至今,其已累计为渤健带来了57亿美元的销售额,随着Zolgensma的上市和Risdiplam的即将入局,其市场份额将被瓜分。