中国首个“突破性疗法”花落传奇生物,有望加速获批早日造福患者
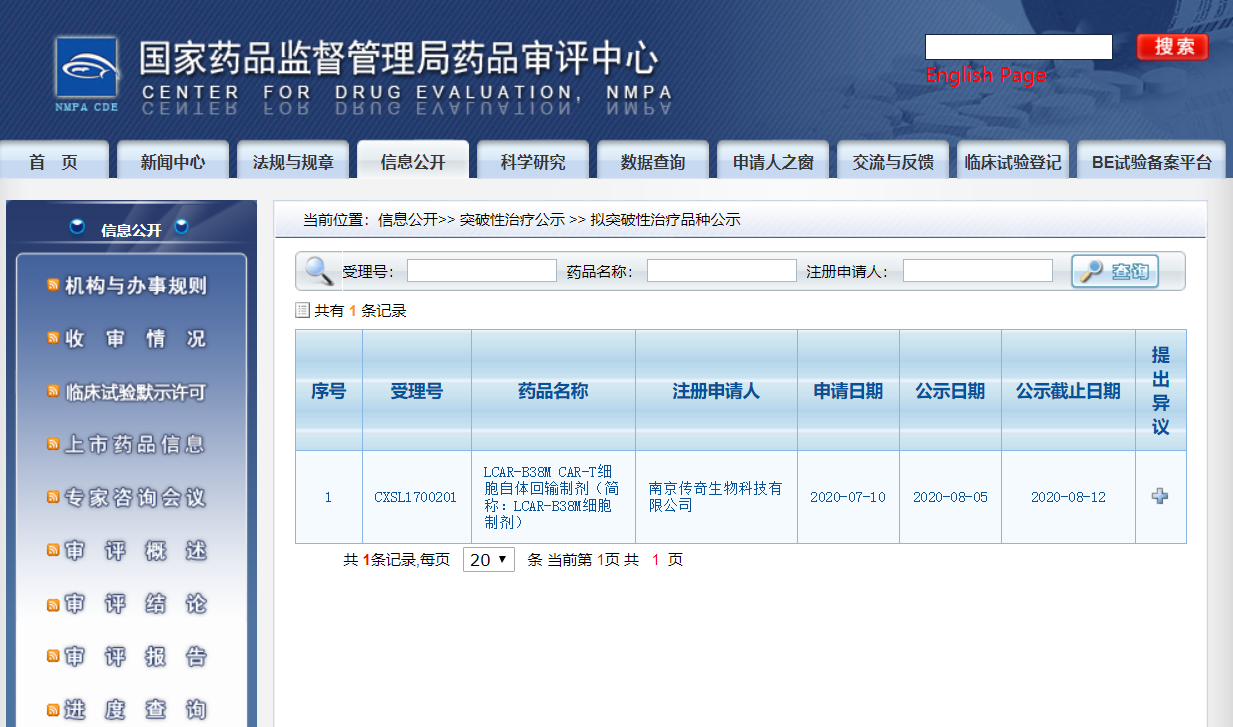
日前,中国国家药监局(NMPA)药品审评中心(CDE)最新公示,传奇生物旗下生物制品1类新药西达基奥仑赛(cilta-cel, LCAR-B38M CAR-T细胞自体回输制剂)拟纳入突破性治疗药物名单,中国首个“突破性疗法”有望花落传奇生物——这是NMPA不久前发布《突破性治疗药物审评工作程序(试行)》文件后,“突破性治疗公示”专栏的首次公示,这也意味着这项特殊审评通道今日正式在中国启动。
“突破性治疗公示”专栏首次公示
据悉,西达基奥仑赛是由传奇生物开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,作为一种结构新颖的CAR-T细胞疗法,该疗法含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,旨在增加其靶向癌细胞的综合能力,用于既往接受过包括蛋白酶体抑制剂,免疫调节剂和抗CD38抗体的治疗方案和在末次治疗期间或之后出现疾病进展的复发或难治性多发性骨髓瘤(RRMM)成年患者。西达基奥仑赛与其他CAR-T产品相比,不但具有独特药物结构,其临床用药剂量明显更小,使用安全性高而疗效却极为优异,在目前全球同靶点药物的注册临床实验竞争中疗效具有优势。
西达基奥仑赛细胞制备示意图
强生(Johnson&Johnson)旗下杨森公司(Janssen)于2017年与传奇生物达成战略合作,在全球范围内共同开发和推广该在研创新疗法。该产品于2018年获得国家药品监督管理局首个CAR-T临床试验申请(IND)批件,并与同年获得美国FDA的IND批准。在获此“突破性疗法”之前,该产品已于2019年获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定。
传奇生物西达基奥仑赛于8月5日拟纳入突破性治疗品种名单
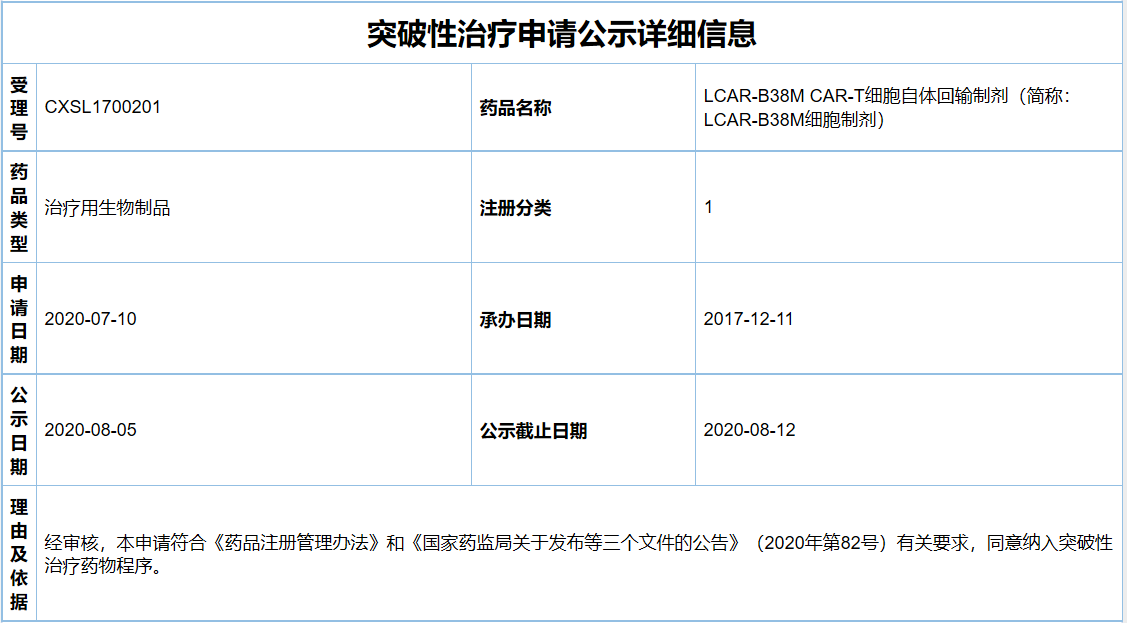
根据CDE公示信息,传奇生物于今年7月10日为西达基奥仑赛申请了突破性治疗,并于8月5日拟纳入突破性治疗品种名单。纳入理由及依据为:符合《药品注册管理办法》和《国家药监局关于发布等三个文件的公告》(2020年第82号)有关要求,同意纳入突破性治疗药物程序。公示时间为7日。这是CDE“突破性治疗公示”专栏首次更新。
在今年6月的ASCO年会上,传奇生物公布西达基奥仑赛在治疗复发/难治性多发性骨髓瘤(R/R MM)患者的CARTITUDE-1的1b/2期临床试验的相关数据。数据显示,在中位随访时间为11.5个月时,所有患者对治疗均有反应,其中,客观缓解率(ORR)保持100%,86%的患者达到了严格的完全缓解。同时,此长期随访数据进一步支持中国LEGEND-2研究的发现,两个研究均显示出深入且持久的治疗反应。
6月,传奇生物作为“中国CAR-T上市第一股”,在纳斯达克挂牌交易,是2020年截止目前生物科技公司最大规模的IPO。据传奇生物招股书显示,西达基奥仑赛将于今年底前在美国提交上市申请,并于2021年在中国提交上市申请。此次西达基奥仑赛拟纳入突破性治疗药物名单,意味着这款产品有望加速获批,早日为患者带来新的治疗选择。
传奇生物首席执行官章方良博士表示,“国家药品监督管理局药品审评中心所推荐授予的突破性治疗药物认定,对于西达基奥仑赛治疗中国的骨髓瘤患者的开发过程是一个重大的监管里程碑,传奇和杨森将合作继续致力在中国及全球推广该试验性疗法。“目前,多发性骨髓瘤仍是一种无法治愈的疾病,因此,发现和开发新的治疗方法至关重要,传奇生物一直致力于为患者提供新的治疗方法,带来更多治愈的希望。同时,传奇生物对其在研品种有着清晰的布局与规划,除此款针对复发难治多发性骨髓瘤(R/R MM)的细胞疗法产品西达基奥仑赛外,传奇的下一代细胞治疗管线集中在恶性血液肿瘤、实体瘤及传染性疾病上,包括了自体和异体CART技术。这将为传奇带来新的成长潜力,助力其成为全球领先的生物医药企业。
传奇生物西达基奥仑赛(cilta-cel, LCAR-B38M CAR-T细胞自体回输制剂)所获国际认可概览
•2017年获国家药品监督管理局(原国家食品药品监督管理总局)受理临床试验申请(IND),并于2018年3月获得中国食品药品监督局确证性临床实验批件
•2017年12月,传奇生物与杨森达成全球合作和许可协议,双方共同开发和商业化BCMA CAR-T产品。杨森向金斯瑞支付3.5亿美元首期款及后续里程碑付款,创下其时中国药企对外专利授权首付款最大金额记录及合作最优条件
•2018年获得美国FDA的IND批准
•2019年2月,FDA授予Janssen的JNJ-4528孤儿药资格
•2019年4月3日, JNJ-68284528(LCAR-B38M)获得欧洲药品管理局( EMA)优先药物认定(PRIME)资格,成为中国首个获得欧洲药品管理局(EMA)优先药物认定(PRIME)资格认证的CAR-T产品
•2019年12月,获得美国FDA突破性疗法认定
•2019年12月,获国家“重大新药创制”科技重大专项支持
•2020年8月5日,拟纳入突破性治疗药物名单
什么是突破性治疗?
“突破性治疗”(breakthrough therapy designation) 是中国国家药监局(NMPA)不久前发布的《突破性治疗药物审评工作程序(试行)》文件的部分内容,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。中国突破性疗法将会是未来一个重要的标签,同样会代表着中国的创新水平。中国突破性疗法最重要的同样是为了进一步加速具有临床优势药物的中国上市进程;进一步满足中国重大疾病的临床治疗需求。
“突破性治疗”有什么优势?
1.“突破性疗法”将缩短漫长而昂贵的开发过程。让早期研究中显示出良好的前景的药物尽快进入市场,而不必完成传统的3个阶段(Ⅰ~Ⅲ期临床研究)的开发计划。
2. 支持了从早期临床试验阶段到上市销售后风险管理阶段的医药创新。
3. 获得突破性疗法的认定,往往预示着该药物较高的上市可能性以及各种利好政策的接踵而至。
4. 除了获得快速审评通道,申请者还获得高效的审评员的指导。
5.“突破性疗法”认证为无药可医或濒临危重的患者带来了福音。