医药服务产业发展趋势分析
一、全球医药外包行业发展现状
全球医药外包市场规模整体增长平稳,2013—2017年年均复合增长率10.3%,2017年总体市场规模达到1041亿美元,其中CRO市场规模446亿美元,占43%,C(D)MO市场规模595亿美元,占57%。未来5年,全球CRO+C(D)MO行业仍将保持高速增长,2022年全球医药外包行业规模将达1784亿美元,年均复合增长率达11.4%。
图 1 全球外包服务市场规模(亿美元)
资料来源:Frost & Sullivan
2017年,外包服务的所有类型中,以小分子C(D)MO市场规模最大,2017年市场规模为583亿美元,其次是临床CRO服务(2017年302亿美元)。从2013—2017年复合增长率来看,受益于细胞和基因治疗领域的加速发展,该领域市场规模增速最快,达23.3%。
图2 全球外包服务及细分市场规模
数据来源:Frost & Sullivan,火石研究院整理
二、我国医药外包行业发展现状
与欧美等发达国家相比,我国医药外包行业相对起步较晚,20多年前才由跨国药企在中国播下医药外包产业的种子。但我国拥有庞大的患者和丰富的疾病谱,在临床试验方面拥有得天独厚的资源;同时我国医药研发成本较发达国家具有非常大的竞争优势,中国临床前试验费用、临床试验费用及生产成本费用仅为发达国家的30%-60%。
伴随着国内医药外包企业研发水平及内部管理水平的提高,我国正逐渐成为国际药企研发转移的首选地。此外随我国药品监管环境的净化,仿制药一致性评价推进,创新药研发加速,MAH制度加速医药行业市场分工,国内企业医药外包需求不断提升,推动我国医药外包行业市场规模不断扩大。
表1 我国与发达国家外包成本比较
数据来源:公开资料整理
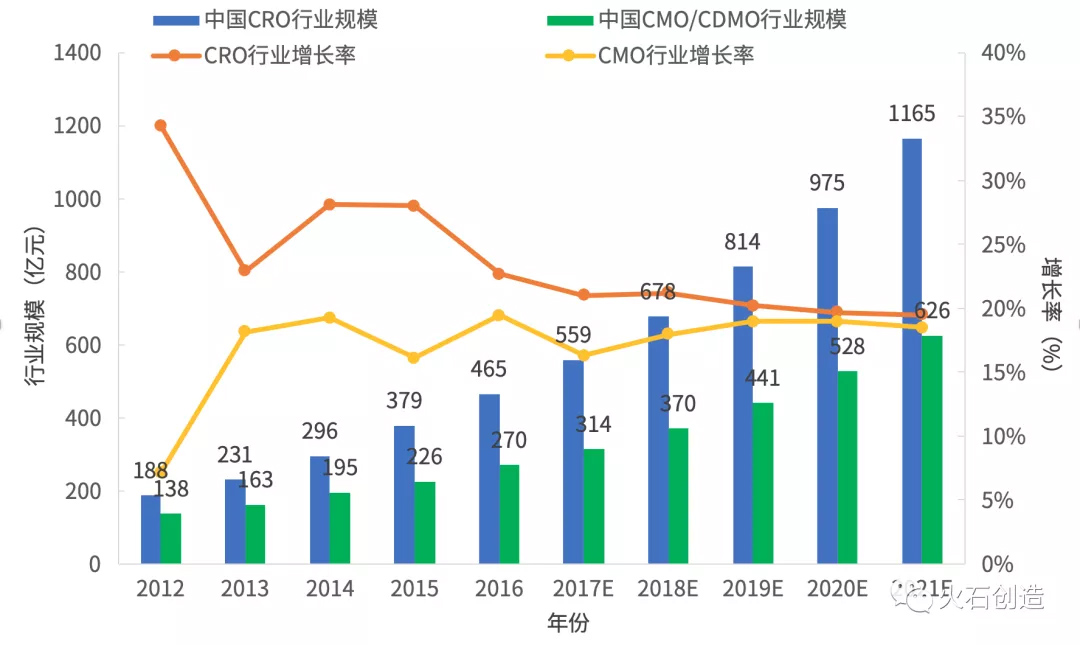
据悉,2012—2016年我国CRO行业销售额由188亿元上升至465亿元,年复合增长率达到25.41%。预计未来五年国内CRO行业仍将在现有基础上继续保持高速增长态势,2021年销售额将达1165亿元,复合增长率为20.32%。2012年至2016年期间,我国CMO行业则由138亿元扩大至270亿元,年复合增长率达16.02%。预计2021年将上升至626亿元,年复合增长率18.14%。
图3 国内外包行业市场规模
三、医药服务产业链发展情况
医药产业链分为研发、生产、销售三大环节(本报告内容仅涉及研发和生产两大环节),医药合同外包服务行业组织的上游取决于该组织所处环节。CRO处于研发环节,上游产业主要是人员劳务、实验动物供应、实验试剂供应、临床试验机构;CMO处于生产环节,上游产业为精细化工行业或生物试剂行业。CRO及CMO公司两者均向制药企业提供外包服务。
图4 CRO/CMO企业产业链上下游关系
资料来源:火石创造研究院
截至2018年年底,国内医药外包企业数已超过1530家:其中主营业务为原料药&中间体为主的企业482家;提供新药研发一站式服务的综合型CRO 172家;非临床类型的CRO 329家;以提供临床相关服务的CRO 194家;为新药提供生产服务的CMO 89家;为药企提供从原料药到最终规模化生产全阶段工艺优化及生产服务的CDMO269家。
图5 医药外包产业企业汇总
资料来源:火石创造研究院
四、我国医药服务产业发展趋势
1. 国内CMO成长迅速,以化学药为主,生物药CMO逐步兴起
中国进入CMO行业较晚,相较于全球CMO巨头,中国从事CMO的企业规模相对较小,但中国因在基础设施、成本结构、技术人才、专利保护方面的竞争优势逐渐成为跨国公司选择生产外包的主要国家之一,根据Bussiness insight的数据显示,2016年我国CMO市场占全球的比例为7.64%,预计到2020年这一比例将提高到9.74%。
目前国内CMO企业主要以化学药CMO企业为主,以博腾股份、九洲药业、凯莱英和合全药业为代表的企业已具备较大的生产规模和竞争优势。我国生物药CMO行业目前仍处于起步阶段,以药明生物为代表的企业正积极布局生物药CMO,未来得益于中国药品上市许可人制度(MAH)、数量庞大的生物技术人才以及蓬勃发展的生物药研发创业企业,中国生物药CMO具有巨大的增长潜力。
表2 国内部分抗药企业生产规模统计数据(部分)
数据来源:公开资料整理
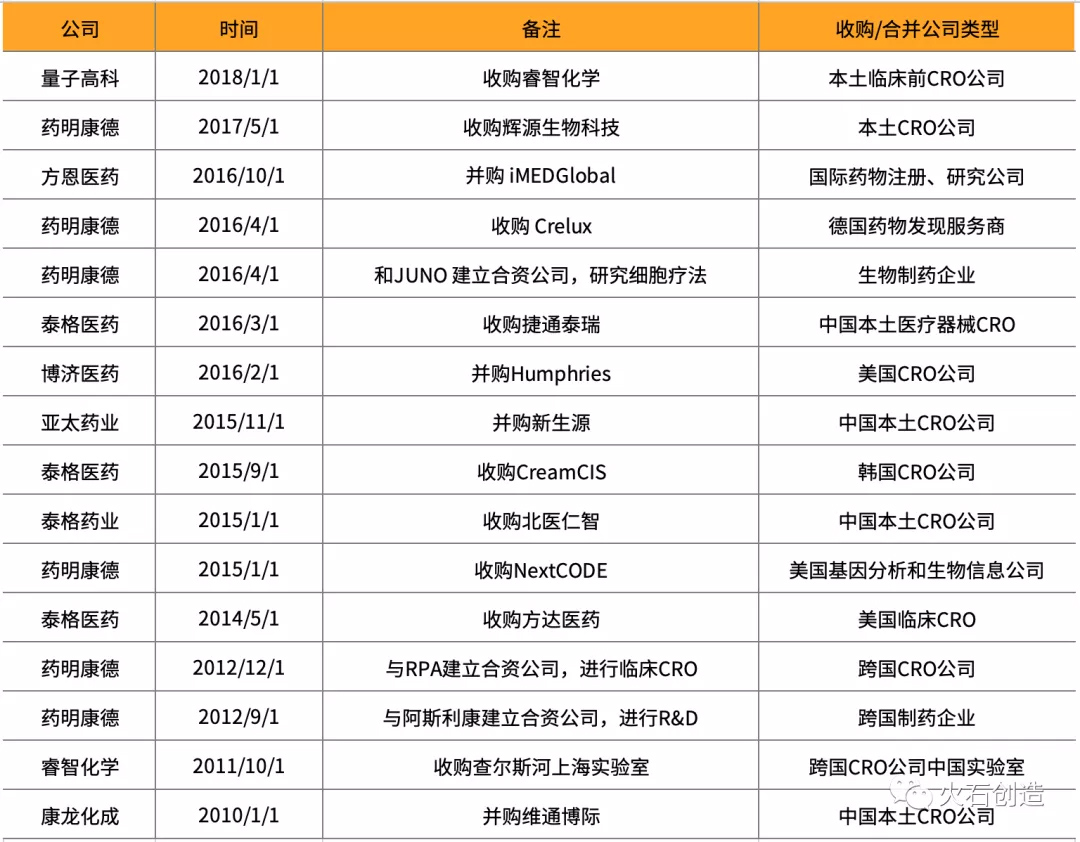
2.国内医药外包企业通过收购合并进行资本和业务扩张
不论是以国际巨头CRO公司的发展路径为例,还是行业发展的必然趋势,行业的重组兼并都为国内医药外包行业的快速发展奠定了坚实的基础。国内行业龙头企业利用资本优势大肆扩张业务范围及服务规模,逐渐实现全方位的一站式服务布局并将业务拓宽至到国际市场范围内。
表3 近年国内医药外包企业收购合并案例
资料来源:公开资料整理
3. 国内具备国际资质认证的CRO企业是国内外药企进行药品全球化布局的首要选择
药品市场全球化能够实现药物研发技术、药物价格的全球融通,同时促进药品市场内部的良性竞争。无论是对于想要国际化的内资药企还是想要拓宽国际市场的海外巨头,具备国际资质认证的医药外包企业都将是这些药企的首要选择。
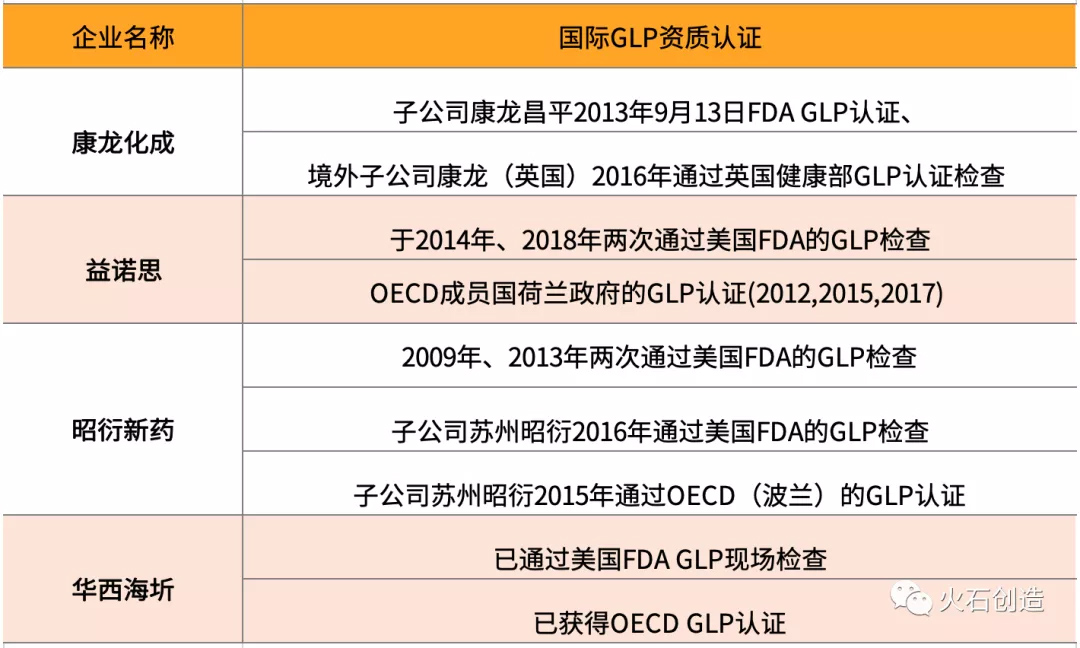
药物临床前研究作为医药研发、生产中的重要一环,各国都有严格的准入和数据认可标准。美国FDA对于GLP 检查、欧洲经济合作与发展组织OECD对GLP的认证(检查)有着极为严格的质量要求,在通过相应检查的同时,企业还将出具相应的研究报告才能顺利被美国FDA和OECD相关成员国认可。因此具备国际GLP资质认证的临床前CRO企业出具的研究数据可以由客户选择进行多地申报,从而获得更多的客户青睐。
据不完全统计,目前国内康龙化成、益诺思、昭衍新药和华西海圻等通过了FDA GLP认证检查。
表4 国际GLP资质认证医药外包企业
资料来源:官网、招股说明书、年报、火石创造研究院整理
为了加快药物在全球的上市及应用,药企可以选择同期在全球多个国家开展国际多中心临床试验,同步获得各国人群的治疗数据。因此,在进行临床CRO选择时,具有开展国际多中心临床试验能力的临床CRO将迎来更为广阔的前景。如药明康德、泰格医药等临床CRO企业已积累了多年国际多中心临床试验的经验。