Nature综述:临床级细胞治疗产品的生物制造
摘要
现如今,基于细胞的免疫疗法已经在临床上取得了重大进展,并进入了推向市场的阶段。包括CAR-T、工程化造血干细胞移植和其他有前景的细胞疗法在内,大量的临床数据集都在增加。因此,为了满足临床和最终商业化规模生产细胞的需求,强调生物制造是相当必要的。
而强大的基础设施应该能够解决目前在细胞收集、扩增、操作、纯化、保存和配制方面的局限性,最终向患者提供可接受的成本治疗方案。在今天的这篇综述中,我们重点介绍了前沿生物工艺技术的案例,这些技术能够提高即将进入临床应用的细胞疗法的生物制造效率。
1. 目标药品的质量概况QTPP
2. 大规模制造的贴壁细胞扩增
3. 高通量细胞分选
4. CAR-T细胞和造血干细胞的生产
5. 降低细胞生产制造成本
6. 细胞储存和供应链管理
重要部分
细胞疗法是一种基于人类细胞的“活药物”,承诺改变包括癌症、神经退行性疾病和自体免疫性疾病等在内的治疗方法。
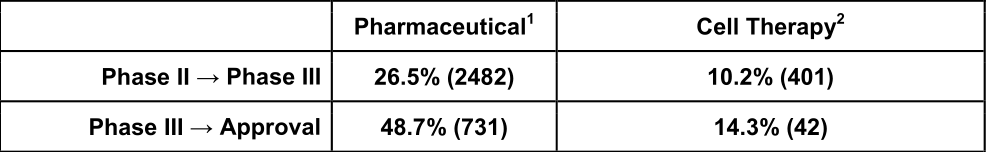
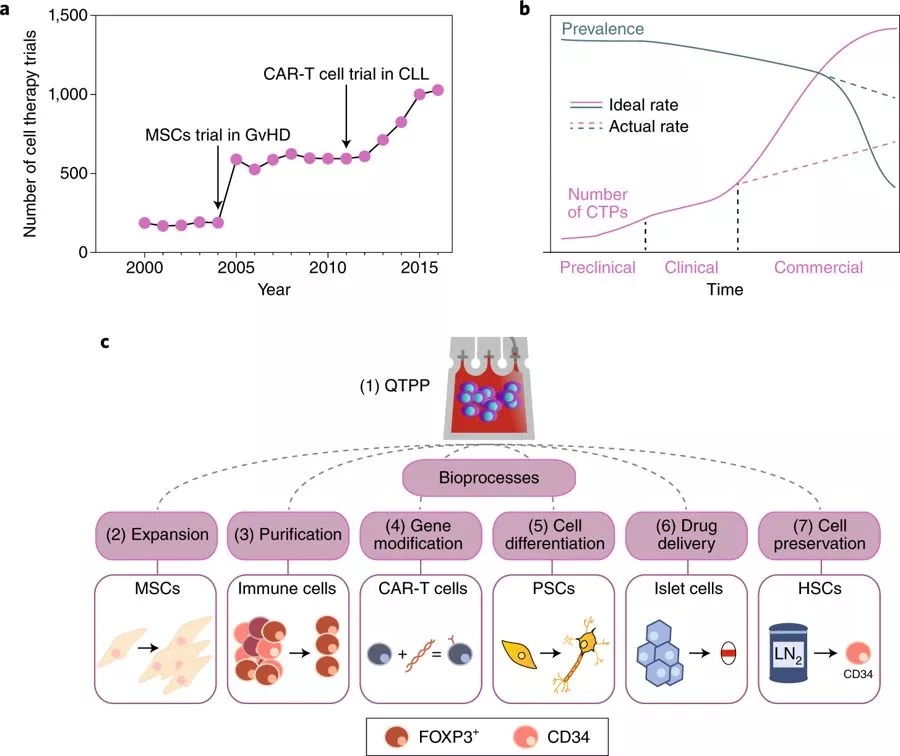
学术界和工业研究的开发工作通常集中在理解细胞疗法如何治疗一系列不同的适应症上,正如最近I-III期临床试验的兴起就突出了这一点(图1a)。在半定量分析的基础上,从III期研究到监管批准的细胞治疗转化率约为14.3%,远低于成熟药物类别的转化率48.7%。(补充表1)。
补充表1:III期研究到监管批准的转化率(图片来源 nature)
随着监管机构批准进行更多的研究,诸如再生医学联盟等组织鼓励进行未来市场分析,以进一步量化和跟踪趋势。最近美国和欧盟对GSK、Tigenix、Novartis和Kite(吉利德公司)的批准为更明确的成功标准带来了新的热情,这些标准有助于将更多细胞疗法推向市场。
图1:细胞疗法的药物经济学与生产制造(图片来源 nature)
细胞疗法的前景伴随着可重复制造和同时向数千名患者提供治疗的新挑战。重要的是要认识到,足以在早期关键临床研究中生产产品的方法可能并不能适应商业化规模。因此,除了目前临床试验的成功率之外,如果不在早期开发阶段进行评估,对常见疾病中细胞治疗的商业规模需求将阻碍CTP(细胞治疗产品)的供应(图1b),而这种供需缺口最终将影响可能无法接受CTP(细胞治疗产品)服务的患者。此外,所涉及的相关物流和经济因素并非微不足道:物理空间、生产时间、人力资源、耗材、废弃物的产生(环境影响)和其他直接成本, 所有这些因素必须纳入制造业蓝图的长远视角。
作为核心角色,细胞制造过程并不新鲜。例如,发酵过程建立基础设施,以生产大批来自细菌和酵母细胞的化学产品。搅拌釜反应器、液相色谱系统和交叉过滤技术等工程工具在新生化产品的开发过程中都已成熟。然后将类似的工具用于生物制药的开发;实际上,细胞现在可以通过工程化以产生纯化的生物制剂,例如单克隆抗体。与使用细胞生产分子试剂不同,在细胞疗法中,最终制造的产品是细胞本身。因此,CTP(细胞治疗产品)的生产需要额外的处理步骤,例如细胞筛选、纯化、配制、保存和分配。这些过程对分子试剂生产所需的技术提出了不同的挑战,特别是考虑到细胞需要进行修饰的次数。然而,过去的制造工具对于CTP(细胞治疗产品)生物过程的开发仍然是有价值的,同时考虑到规模化和降低成本。生物制造代表了美国先进制造合作计划的重要推动力。
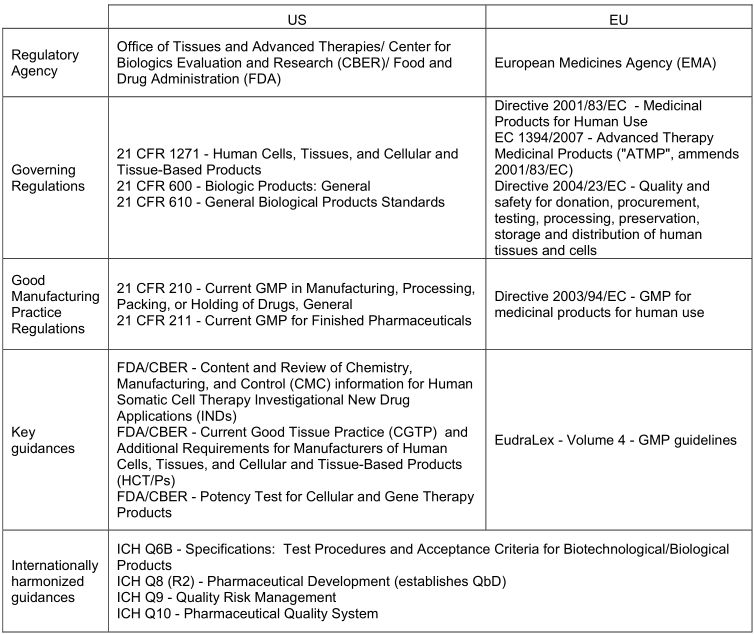
例如,过去几十年来,血液制品和骨髓产品的处理为人类细胞疗法的发展树立了先例,并为需要满足的基本质量规范奠定了基础。因此,以前为药物和分子生物学而建立的法规、标准和指导现在也可以用于细胞疗法。虽然具体法规因地区而异,但每个法规都要求生物制造解决方案支持符合当前的药品生产质量管理规范(GMPs),以通过适当的设计、监控和控制生产过程和设施来确保人类使用的产品的质量和安全性。(补充表2)提供了美国和欧盟管辖区的监管参考摘要。日本已经建立了再生医学监管框架,且该框架已被美国通过21世纪治愈法案部分采用,并通过新的再生医学和高级治疗指定加快监管审查,以解决产品开发问题。
补充表2:美国和欧盟管辖区的监管参考摘要(图片来源 nature)
评估CTP(细胞治疗产品)制造的关键决策点是自体和同种异体细胞疗法之间的区别。尽管它们具有相同的最终目标——生产高质量的细胞治疗。但在制造方面,两种方式之间存在明显差异。自体疗法具有相当大的额外后续挑战,因为封闭分布模型意味着无法创建广泛分布的产品库存,将可变的患者衍生细胞回输到体内需要稳健的过程以确保最终产品的一致性;
在给定个体化治疗方式的情况下,每个CTP(细胞治疗产品)也需要患者筛查和释放测试。用于自体治疗的自动化即时技术可以在医院现场制备产品,然后需要医疗设备(510k US)分类。
目前的趋势表明,自体疗法通常以~1 l scale进行,而同种异体细胞疗法的生物过程计划以>100 l scale进行。同种异体疗法需要包括对细胞库的广泛测试,但不需要对所有患者进行广泛筛选以生产散装材料。虽然批量生产可以通过规模经济帮助降低成本,但是通常需要更大更昂贵的设备设施。经营一个生产基地以满足即将到来的CTP(细胞治疗产品)需求,必须在规定的时间内生产一定数量的产品,这就带来了对间接成本的进一步关注,尤其是人员成本。
在这篇综述中,我们讨论了用于临床先进细胞疗法的细胞产品的制造,并强调了在实现商业生产可扩展性之前可能面临问题的生物过程(图1c)。我们首先描述当前对产品质量的理解。然后,我们回顾了关键的生物过程,并突出了细胞扩增、细胞工程、细胞分化、细胞纯化,细胞生物材料配方、细胞保存和细胞运输的瓶颈。每个生物过程都作为案例研究提供,并与特定的细胞疗法实例配对,选择这些实例为实际应用提供背景。此外,我们还讨论了可以维持或改善这些生物过程控制的新兴工程解决方案。
目标药品的质量概况QTPP
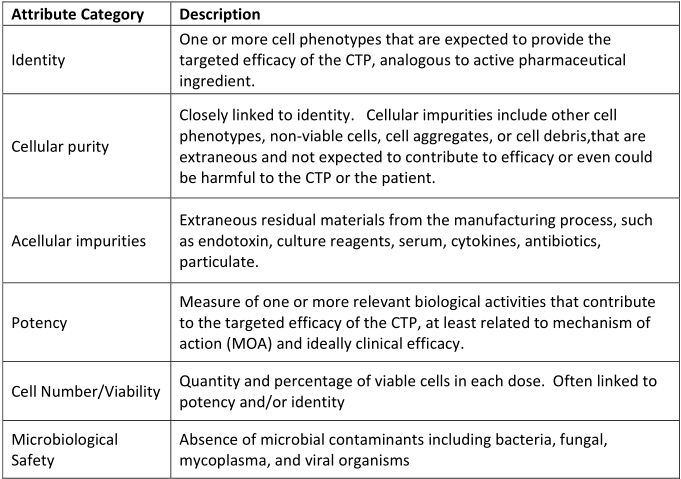
随着先进的细胞疗法的出现,需要一个产品开发和管理的监管框架。一个例子是人用药品注册技术要求国际协调会议(ICH),该委员会通过设计建立了质量框架(ICH Q8 - 药物开发,2009年8月)。目标药品的质量概况(QTPP)通过生物过程工程师可以在特定阶段的开发计划中努力的指标来定义CTP(细胞治疗产品)的关键属性。(补充表3)提供了通常需要为CTP控制的属性范围的描述性摘要。
补充表3:细胞治疗产品(CTP)质量属性的描述性总结(图片来源 nature)
这些属性构成了产品规范的基础,这些规范是根据广泛的分析方法来度量的(Publicly Available Specification(PAS)93:2011-用于临床应用的人体细胞的表征提供了全面的总结)。
然后可以开发和应用生物处理工程控制,以确保生产性能达到或超过这些规格的产品,同时认识到基于细胞的产品的固有复杂性、显着的异质性和批次间差异。例如,这将需要创新的细胞处理解决方案,其适用于从一个阶段到下一个阶段细胞起始材料的可变输入,并且产生具有抑制可变性的标准化输出。
应该在CTP(细胞治疗产品)开发的早期优先考虑效力,因为它最终证实了CTP的实用性。效力是做出关键决策的标准,包括产品批次放行、保质期、不同地址生产的产品之间的可比性,以及临床准备的验证。然而,由于CTP的许多复杂性质以及它们对作用机制和自然批次间变异性的了解不足,定义和测量的效力可能具有挑战性。在理想的产品中,一系列因果关系研究将CTP的(预)临床功效与其作用机制及其相关的可测量的生物活性联系起来,并与实验室测量效力的定量分析相关联。(补充表4)总结了针对一系列CTP追求的效力量化的示例性方法。
补充表4:细胞疗法以及它们相应的效能测试的例子(图片来源 nature)
效力也与CTP(细胞治疗产品)的组成直接相关,由一组质量属性定义:纯度和一致性。
其中一致性定义了’活性药物成分’',纯度将CTP与任何非药物细胞(被认为是杂质)区分开来。通常情况下,用每一种细胞类型的精确频率来产生纯细胞成分是不现实的。挑战在于剖析不同细胞发挥的积极和消极作用。
例如,在使用嵌合抗原受体CAR-T细胞的免疫疗法中,其中CD19-CAR-T细胞是活性剂(补充表4),CD4 +细胞是CD3 + T细胞的子集,可以被认为是产品的一部分或杂质。分离、转导和扩增T细胞的过程可能会导致组成T细胞的不可控的比例变化,因为从一个病人到另一个病人的比例变化,以及由于T细胞类型之间的可变扩展特性。增加对混合细胞成分的控制需要额外的制造步骤,导致产品成本的增加,然而为每一个单元操作设计创新的过程设计,能够建立一个有利的成本效益权衡。
另外,量化与QTPP相关的产品属性的测试方法也可能是工程挑战。例如,体外效力生物测定可能需要开发以量化产物释放的效力。此外,CTP必须经过认证,不含微生物和其他制造残留物,如培养试剂。在这方面,正在探索通过对血液制品及其组成部分进行选择性破坏来减少病原体的治疗方法,例如快速和在线检测方法和封闭的微流控系统以及其他固有地消除微生物污染风险的技术。因此,需要工程解决方案来建立敏感、及时和经济有效的测试方法,以反映CTPs的独特性,同时提供始终如一地满足关键质量属性的稳健性。
大规模制造的贴壁细胞扩增
细胞疗法有时可能是“质量效应”的结果,也就是说,体内再生或免疫过程所需的细胞需要大量存在。因此,通过增加病理状态下的细胞数量,治疗的平衡可以倾向于修复。在这些情况下,培养足够数量的细胞对于递送有效剂量是必不可少的。
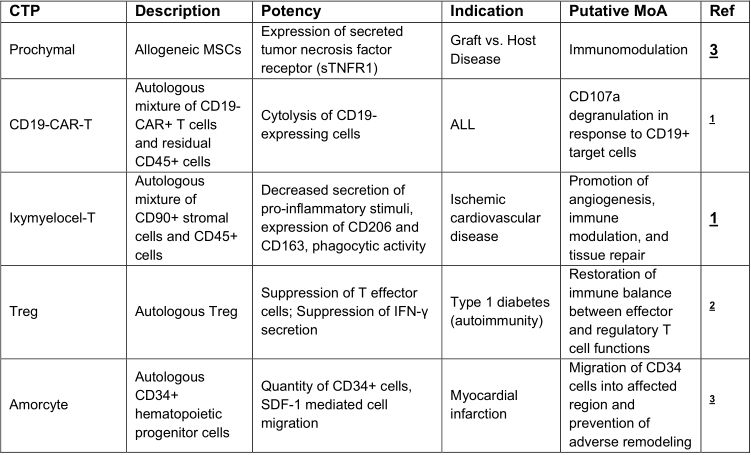
细胞扩增方法可用于CTPs的分类;例如,悬浮培养与贴壁培养。其中悬浮培养以空间有效的形式具有高产量的益处。相反,当以商业规模开发时,传统的贴壁细胞培养方法需要大量且在逻辑上不切实际的平面表面区域,以用于细胞的生长。间充质基质细胞(MSCs)是一种贴壁细胞疗法。因为能够在细胞输注后释放一系列营养因子, MSCs有望用于治疗造血功能衰竭、移植物抗宿主病、以及胃肠道、皮肤、心脏、肺、肝和肾疾病损伤。鉴于其易于分离和相对低的免疫原性,同种异体MSC产品已进入临床试验的最后阶段。现在对大规模生产的需求至关重要,因为单剂量在1-10百万MSCs kg-1范围内。传统上,MSCs在二维(2D)表面上培养,例如烧瓶或多层细胞工厂(图2a),并且预计大规模运行的批量大约为100-500亿个细胞;然而,2D方法难以按比例放大并且在商业规模上经济有效地运行。很明显,目前的二维培养系统不足以满足未来商业可行性的需要;相反,需要可扩展的闭环和潜在的自动化技术。
图2:用于扩增细胞和从微载体收集细胞的过程优化(图片来源 nature)
例如,3D贴壁生物反应器Quantum Cell Expansion System(Terumo BCT)是符合GMP标准、一种功能上封闭的中空纤维系统,用于临床上MSC的扩增。该系统可在2周内产生约1×10^8个细胞,从而满足国际细胞疗法学会定义MSC的最低标准。在撰写本文时,FDA已批准一个初始系统用于早期试验的临床应用。
面对数千名患者,从粘附的2D培养过渡到粘附的3D培养是细胞商业化生产的最佳途径。此外,还有一种选择是使用微载体,即支持微粒基质,允许细胞在3D条件下扩增(图2b)。MSC粘附于微载体上并在搅拌槽生物反应器(体积为300ml至1000 l)中培养以进行大规模扩增。尽管微载体技术具有扩大规模的优势,但在生物反应器培养环境的优化方面仍存在许多挑战(图2c和补充表4);例如,提供代谢底物(氧气)的需要对于商业上可行的制造是至关重要的。
实际上,在任何扩大规模的尝试之前,人MSC低于理想的细胞密度和低的特定摄氧率是必须解决的问题。因此,生物反应器系统密切选择和控制诸如溶解氧的过程参数的能力可用于改善产品质量并提高产量,而不是基本上不受控制的2D方法。由于溶解度有限,需要连续供应氧气;然而,随着细胞密度的增加,可能需要通过喷射来提供氧气,通常用空气喷射,这可以除去产生的二氧化碳。然而,喷射需要在介质中包含保护剂,最常见的是表面活性剂Pluronic F68,其可以诱导破坏性空化气泡,导致细胞活力降低。
使用无血清介质是降低每剂商品成本的一个机会。与微载体相结合,无血清培养基可以增加产量,减少与血清培养基相关的可持续性风险。
使用GMP-ready技术和xeno-free培养基已经在微载体工艺开发方面取得了一些进展。例如,使用基于无孔塑料微载体的1升搅拌槽生物反应器(SoloHill Engineering)培养7天后产生1.1×10^8骨髓间充质干细胞(BM-MSC)和4.5×10^7脂肪组织间充质干细胞(AT-MSC)。
最近,使用合成微载体(Synthemax-II microcarriers)和xeno-free培养基与静态培养物和旋转瓶的2升一次性生物反应器的比较显示了生物反应器的可扩展性优势。使用塑料微载体在搅拌罐5升生物反应器中生长12天的人BM-MSC保留了关键品质,在第8天和第12天细胞样品中具有匹配的活细胞计数,这些研究累积地支持了放大比例的可行性。
微载体可以由不同的材料制成,支持不同的尺寸,呈现不同的孔隙率和不同的化学性质,因此可以针对特定的细胞生长条件进行优化。但选择细胞生长的最佳条件并非易事,这往往是该技术的一个主要难点。材料科学的方法,如可生物降解的微载体或温度敏感的微载体(图2d),将减少下游分开和分离方法的需要,分离出MSCs用于需要直接植入组织的临床适应症,例如骨形成。
对于需要静脉内施用MSC产品的临床适应症,可以通过使用两相液/液系统完全去除微载体以形成用于MSC扩增的临时微载体表面。培养后,然后可以分散临时微载体表面,产生液/液界面,收集MSC并且可以从中收集MSC作为单个细胞,而不需要酶溶液来分离MSC(在塑料微载体工艺中需要)。从生物反应器制造过程中去除微载体并减轻下游挑战的另一种方法涉及通过形成球状体来培养悬浮的MSC。这种扩增方法已证明改善了MSCs的临界质量属性和临床前疗效。
但是,与现有的贴壁扩增方法相比,还需要大力开发以保持MSC扩增潜力的水平。引入能够给这些材料带来工业稳健性的标准-科学解决方案将有助于建立高密度的MSC悬浮培养物,易于收集和分离,最终生产出高纯度MSC产品。
高通量细胞分选
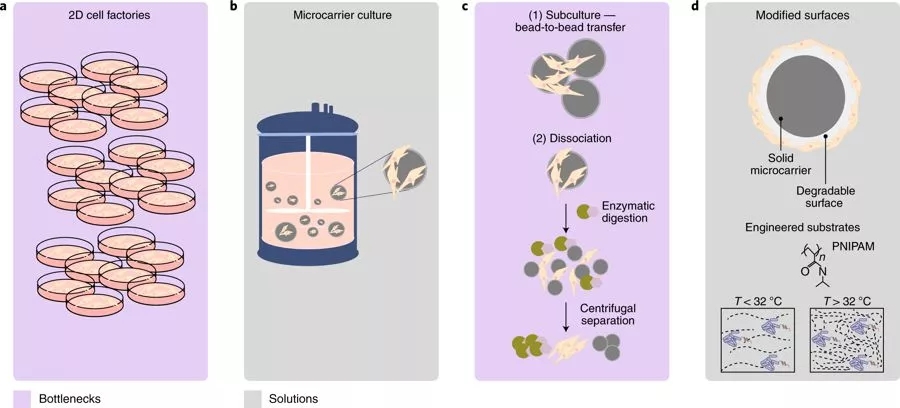
在细胞疗法中,必须分离和富集具有最佳纯度,通量和产量(相互依存的参数)的特定细胞群。细胞疗法中的分离技术可以分为两类:细胞-细胞分离,其目的是将一种细胞表型从另一种细胞表型中分离出来;和细胞-溶液分离,洗涤细胞群并更换培养基。细胞-细胞分离通常通过化学和机械方式实现,常见的方法包括Ficoll通过密度分离分离红细胞、血小板和单核细胞,逆流离心淘洗根据大小和密度分离细胞,荧光激活或磁激活细胞分选(FACS或MACS)分离基于特定属性的细胞。设备已经标准化了消除制造瓶颈的过程,特别是在自体细胞疗法制剂中。
为了限制生物学变异,分离细胞群是细胞制造的关键步骤之一。例如,CD3 +白细胞必须从血液衍生物中纯化,最常见的是通过血液成分分离程序。同时,去除非目标成分是非常重要的,如单核细胞、粒细胞、红细胞和血小板,这些可能会对下游产生不利影响。
为了实现更高纯度的产量交付,使用的最常见的富集方法是抗CD3涂覆的磁珠(图3a)。这些珠子与靶细胞结合,然后通过将细胞悬浮液置于磁场中来纯化。但这种方法通量低,需要昂贵的试剂,并且经常依赖于耗材唯一供应商(其承担供应链风险)。另外,在体内使用磁性标记细胞存在一些安全问题,Dynabeads(免疫磁珠)要求接受的释放标准为每3×10^6个细胞≤100个珠子。在研究新药计划(IND)下运作时,Miltenyi(美天旎)的CD34磁珠获得了FDA的商业化使用许可。
已经商业化的产品还包括Quad Technologies的MagCloudz(图3b),其通过可溶解的抗体涂覆的水凝胶将磁珠与细胞进行物理分离,导致底物溶解后无珠子的下游产物。
图3: 高通量无标记纯化(图片来源 nature)
FACS通常与结合荧光染料的抗体组合使用以标记细胞,并根据它们的激光触发激发程度选择它们(图3c)。与MACS相比,FACS最适用于需要几种标记来识别和纯化CTP的情况。这在用于自身免疫疾病的人Treg细胞的纯化中是必需的。
分离和扩增外周血T细胞,随后使用一组抗体通过细胞外染色进行FACS分选,所述抗体识别具有CD4 + CD25HiCD127- / Low的表面标志物表型的细胞。这种方法在临床上被用于Treg细胞l纯化,尽管在商业制造中维持这种工作流仍然是一个挑战。许多用于无标记纯化细胞的解决方案(图3d)正在研究中,尤其是微流体技术与声学、粒析或拉曼散射的结合使用。其中SonoSep使用的是声波分离技术,但到目前为止仅在实验室规模上进行了演示。介电电泳已经显示出基于膜电容分离细胞的希望,但目前只能以每小时150000个细胞运行,这表明个体患者的单采血液成分需要将近50小时才能完成。因此,尽管有大量技术进展,但仍然存在实现CTP可扩展性、质量和临床实施安全性的挑战。
CAR-T细胞和造血干细胞的生产
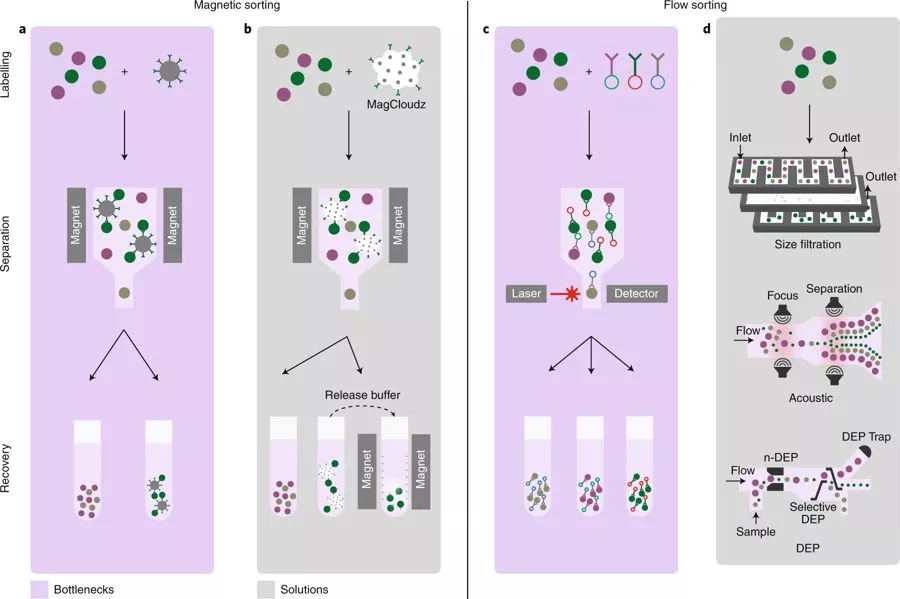
细胞工程通过遗传操作对细胞进行改造(图4a),使研究疾病机制、识别新药物、操纵细胞功能以获得生物制剂和基于细胞的疗法成为可能。而将基因变化引入细胞的方法有很多,它们通常被归类为病毒或非病毒。
后一类一般是通过化学基础产品(例如脂质体)或通过非化学方法(例如电穿孔)将核酸引入细胞的转染技术,其中电穿孔技术已被用于引入RNA以瞬时修饰细胞功能,完全期望仅发生新遗传物质的短暂表达。为了实现转基因的稳定表达,在宿主细胞中引入编码转座子元件和转座酶的质粒组合的转染方式已经被使用(例如Sleeping Beauty和piggyBac转座子系统);该方法相对具有成本效益,并且已经用于CAR-T细胞治疗白血病的早期临床开发中。
然而,最常见的是,原代细胞和干细胞需要病毒转染的方法,而不是电穿孔,以有效和稳定地递送遗传物质。然而值得注意的是,基于体外病毒基因治疗的方法经常被纳入生物处理工作流,用于生产细胞疗法。
图4:采用不同基因修饰方法的细胞疗法(图片来源 nature)
细胞工程的一个突出例子是使用T细胞免疫疗法靶向肿瘤相关抗原。其中,表达CD19受体的CAR-T细胞,已经获得FDA批准,用于治疗复发或难治性急性淋巴细胞白血病青少年患者以及难治性大B细胞淋巴瘤成人患者。
首先,从患者的外周血中收集静息的多克隆T细胞,并在转导和纯化之前用CD3或CD28磁珠活化以诱导扩增。作为人工免疫受体,CAR赋予细胞特异性,活化和共刺激分子。
另外的转基因可以包括在载体中,包括细胞因子、免疫调节蛋白、表面膜标签和自杀基因。虽然有CAR瞬时表达的例子,但患者的长期疗效仍有待证实。相反,稳定的嵌合受体表达和这些细胞的持久性是目前的标准,并且可能是有效性所必需的;因此,使用逆转录病毒载体将CAR稳定地导入细胞。通过改进载体设计、制造以及使用诸如retronectin的附加试剂来帮助产生阳离子电荷以促进病毒转运到细胞中(尽管这个过程很昂贵),显着提高CAR构建体的效率。
而且载体制造过程难以标准化。其高度可变、依赖专业知识,需要灵活的制造过程,而且成本很高。虽然可以使用少量载体从而降低成本,但是这需要延长新工程化细胞的培养步骤,以获得治疗剂量的工程化T细胞。
目前,细胞工程也已成功应用于各种单基因疾病的基因治疗,包括重症综合性免疫缺陷、Wiskott-Aldrich综合征、慢性肉芽肿病、脑肾上腺脑白质营养不良和血红蛋白病。在这种情况下,CD34+ 自体造血干细胞(HSC)是从任一骨髓或外周血中分离,用造血生长因子的混合物刺激,在启动子的控制下,通过逆转录病毒或慢病毒载体携带有缺陷基因的正常拷贝进行转染。最后,经过基因修饰的HSCs通过静脉注射后移入骨髓,在骨髓中植入并产生表达正常蛋白的分化细胞。
在患者的预期生命期限内,需要将载体整合到长期存在的HSC中以产生正常分化的细胞。在大多数情况下,需要进行预处理以消除患者的至少一部分异常HSC并促进遗传修饰细胞的植入和持久性。在γ-逆转录病毒载体引起的插入诱变导致患者病情进展后,研究人员便开始探索能够替代的载体,包括慢病毒和腺病毒,以及载体设计和自我失活载体使用的改进;最近的研究没有观察到载体优先整合到潜在的致癌区域,但未来,基因编辑方法可能取代基因转染;除了避免潜在的插入诱变事件外,通过基因编辑对内源性突变序列进行修正,应能够在生理条件下控制基因表达的内源性启动子的控制下产生正常的基因产物。这可能会增强工程化细胞的效力,并使移植后的HSCs功能正常化。
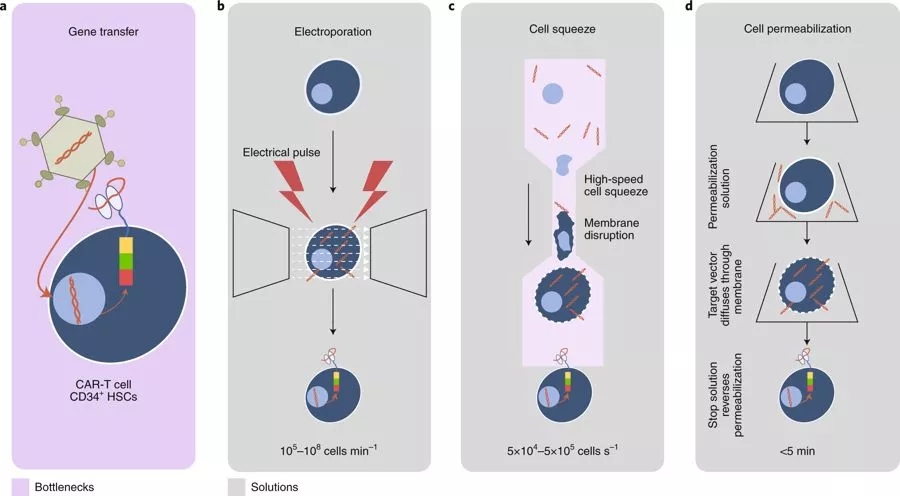
预期提高细胞转染方法的效率会对可扩展性和成本产生很大影响,其中电穿孔是最常用的方法,而且现代的电穿孔技术能够在保持高效率转染的同时还能显着减少细胞损伤。尽管细胞恢复和可扩展性差,但这种经过验证的技术仍适用于临床应用。
MaxCyte(图4b)、Nucleofector(Lonza)和Gene Pulsar(Biorad)等技术有效地提高了转染规模。Lonza的Nucleofector产品组合可以有效转染难以转染的细胞系和具有不同底物的原代细胞,包括DNA载体和短发夹状RNA、microRNA和短干扰RNA寡核苷酸。
该系统的通用型允许转染贴壁细胞,并且对细胞数量和状态具有灵活性,添加96-well模块或独立反应系统(如高通量核转染系统)的能力可以实现高通量转染,在不到5分钟内对至少2×104个细胞进行转染或利用4D-Nucleofector LV装置转染多达1×109个细胞。转染效率依赖于细胞类型,外周血单核细胞可达到约70%的效率,未刺激的人T细胞可达到90%。
MaxCyte为大多数常用细胞类型提供> 90%的转染后细胞活性和> 90%的转染效率,允许在几秒钟内在0.5×10^6和0.7×10^8个细胞之间的可扩展性,在不到30分钟内可达到2×10^10个细胞。但用于转染的电穿孔缓冲液和工作流程仍然存在问题,因为无葡萄糖和无蛋白质的缓冲液可导致细胞的恶化。虽然如此,一些临床试验已经使用电穿孔方法用于CAR-T细胞的制造,以及基因编辑策略,例如CRISPR/Cas9)进一步修饰或改进工程化T细胞产品。
吞吐量并行处理是实现自动化解决方案和分散式制造的重要步骤。例如,制造CAR-T细胞的半自动闭合系统Miltenyi Prodigy:包括T细胞刺激、转导和扩增的整个过程,在一台仪器中进行,能够在不到30分钟的时间内电穿孔至多50ml的细胞悬浮液。
SQZ生物技术公司正在开发一种微流体通道,这种通道可以挤压细胞(CellSqueeze),在细胞膜上形成小气孔,通过这些小孔,可以在保持细胞存活能力和功能的同时输送物质(图4c),并且能够每秒处理100万个细胞。
ThermoFisher Scientific的Neon转染系统可确保在许多细胞类型中效率高达90%,每次反应能够从2×10^4转染至6×10^6个细胞。具体而言,通过使用该技术,可以以23%的效率和95%的存活率转染外周血单核细胞。该设计的主要优点是更好地维持生理条件,与常规电穿孔相比,其能够获得更高的细胞存活率;然而,它配备了镀金电极的高运行成本,具有专有的转染缓冲液,以及Neon移液器吸头和管的成本。
Avectas开发了一种专有的输送解决方案,它最初使细胞膜透化,允许输送材料扩散到细胞内,然后逆转透化(图4d),有效控制负荷。Avectas的递送效率为~53%,细胞存活率为78%(相比之下,电穿孔的效率和细胞存活率分别为93%和73%)。对于大多数方法,有效递送必须与维持细胞活性平衡,以提供可扩展的解决方案(Avectas还开发用于GMP制造的封闭连续系统)。
有效细胞工程的另一个途径源于纳米粒子的研究;事实上,已经有研究表明可生物降解的聚合物纳米颗粒可以转染大量细胞。虽然每种方法通常依赖于细胞类型和目的,但生理学相关细胞的转染效用仍然是一个挑战,关键的瓶颈是实现可重复的有效转染,低细胞毒性以及高通量输出。
降低细胞生产制造成本
2007年,通过使用转录因子的组合将人成纤维细胞遗传重编程为诱导的多能干细胞(iPSC)。iPSC在生长特征和要求,多能性和重编程成各种成体体细胞的能力方面类似于胚胎干细胞(ESC)。并且考虑到伦理这一方面,更易于推进。
然而,一方面,来自胚胎的每一个ESC细胞系都有主要组织相容性复合体和其他抗原的独特表现;因此,从再生医学和移植的角度来看,使用从第三方胚胎干细胞分化的体细胞会提高细胞受体排斥的机会。另一方面,因为GMP级别的iPSCs可以源自自体体细胞,所以可以减轻来自iPSC的分化细胞引起的排斥问题(图5a)。已经提出建立ESC细胞库(haplobanks),代表在不同群体中观察到的主要组织相容性抗原。
这可以解决大量人群的移植排斥问题,并且可以解释胚胎干细胞(ESCs)是否能立即分化成各种组织类型。此外,分化的iPSC也可能在药物筛选中非常有用;例如,iPSC衍生的分化细胞系的集合可以基于种族和性别组装成子集,这是影响药物开发的几个因素中的两个。对于遗传变异主要决定疾病发生和发展的疾病,而不是基于可能不精确的临床诊断对样本进行分组,也可以对不同的基因型iPSCs进行分组。这种方法可能对神经和神经精神疾病特别有用,因为新鲜的脑组织通常是不可获得的,而且这些疾病通常是由多种不同的遗传原因引起的。
图5: 用于将PSCs区分为视网膜和神经细胞谱系的当前工具概述(图片来源 nature)
这些应用都说明了iPSCs的潜力。然而,通过衍生自完全分化的细胞来生产CTP(细胞治疗产品)的销售成本是巨大的。为iPSC生成细胞库是一项手动且劳动密集型的任务,需要大量的人力资本成本。每个重编程和临床有用的iPSC群体可能需要数月才能从原代细胞集合中发展。推荐大约200-300个小瓶,每个小瓶约2×10^6个细胞,以具有足够数量的iPSC以扩增起始材料并产生最终产物。
一些公开报告指出,生产和验证每个细胞系的成本约为10000-20000美元,满足当前GMP要求的额外成本介于每个细胞系50000美元至100000美元之间。产生适合临床使用的iPSC衍生组织产品的产品开发成本甚至更高(约800000美元)。而且这些数字都排除了iPSC制造人员、设施和专用设备的大量启动成本。虽然用于自体疗法的iPSC似乎是一种替代方法,但是相同的限制范围和个体化筛查问题使得基于自体iPSC的治疗变得困难。
衍生自iPSC的细胞制造中的商品成本与所需的细胞处理和纯化的量密切相关,从iPSC自身的衍生和维持开始。与CAR-T细胞的制造相反,iPSC的产生仅需要重编程基因的瞬时表达。通过仙台病毒载体(细胞质RNA病毒载体)、非整合型附着体载体、信使RNA转染和其他方法引入重编程因子,从多种成体细胞类型中衍生而来,不需要载体整合到宿主基因组DNA中,避免了插入突变的威胁。然而,除了将成体细胞设计成iPSC所需的培养基条件之外,与产生这些转基因相关的成本还是很高的。
基于GMP和xeno-free试剂(如mTeSR1培养基,StemCell Tech)创建定义的培养基(图5b,c),最大限度地减少了手工菌落采摘和继代培养所需的劳动力,尽管培养基需要生长因子,但这可以重新平衡这些增加的成本。另外,虽然iPSC可以在确定的培养基中生长,但是对生长基质(例如Matrigel)的需求使得大规模培养成为挑战。
细胞聚集体或微载体中的三维培养,例如通过使用旋转锥形瓶、波动反应器、旋转壁生物反应器或搅拌釜反应器,这是干细胞培养方法的合理进化。尽管这些系统允许细胞的大规模扩增,但它们也提供了新的培养变量。
来自iPSC或ESC的分化过程也需要优化以使用定义的细胞谱系作为CTPs(细胞治疗产品)。来自发育生物学的知识现在可以通过特定的,定义的生长培养基转化为实践,这些培养基概括了谱系特异性分化过程(图5d)。用于产生分化的细胞衍生物的方案处于初期阶段,需要过多的时间和劳力,并且通常会产生相对不成熟的细胞。目前的策略通常涉及为多能干细胞(PSC)的起始群体提供特定谱系的必要因子。这可以通过重建PSC的3D生态位的特性来间接实现,或者通过将所需的细胞因子和生长因子直接喂养到培养的PSC中来实现。
但这两种分化方法都需要长而昂贵的培养方案,需要大量细胞因子和生长因子以及长培养时间(50-100天),并且在细胞成为CTP之前需要频繁的人工处理。而且,除了未分化的PSC的直接致瘤风险之外,iPSC和ESC细胞系的连续培养可能引入总染色体改变和特定基因中的小突变的累积,以及对iPSC的衍生、表征、分化和纯化不容易自动化。
设计用于指导PSC分化的小分子可以提供超过生物制剂的显着成本优势,并使PSC制造和扩大规模的经济性更具吸引力。然而,合适的小分子的设计需要了解管理谱系定型的调控网络(图5e)。解决这些问题以产生候选目标的一种方法是使用大规模基因组学和蛋白质组学。
事实上,在使用小分子将PSC定向分化成定型细胞谱系方面已经取得了一些成功。此外,由CRISPR和转录激活器的效应核酶所激活的基因操作的日益简化,开启了一种可能性,即用一种内在的事件序列取代定向分化的外在控制。
例如,引入可调的基因片段来调节发育路径,减少了对外源性因素及其相关产品成本的持续供应的需要。可以低成本制造的调节RNAs的利用(图5f)是通过降低成本实现可行的CTP(细胞治疗产品)扩大的另一个令人兴奋的途径。微小RNA显示出实现定向分化的希望,并且大基因间非编码RNA与多能性的诱导密切相关。基因传递技术的效率肯定会加速这些方法在标准实践中的引入。
下一代合成生物学和基因编辑工具也可以用于创建新的生物加工工具。改进的方法和试剂应该促进可重复的方案的创建,以持续地诱导人类分化细胞类型。
细胞储存和供应链管理
尽管在医院或学术环境中进行的许多早期试验的细胞治疗产品的保质期受到的关注有限,但生物保存将在后期临床试验中发挥作用,并最终在商业化中发挥作用。设计质量原则和保存解决方案允许产品满足关键质量属性,例如效力,必须在后期试验中应用,因为起始和最终产品材料必须在临床场所和生产设施之间运输。通过最大化制造计划和患者治疗的可能性,延长产品保质期的生物保存解决方案也将促进物流的发展。
冷冻保存:在极低温度下储存细胞(液氮为-196°C,蒸汽氮为-156°C;优选以蒸汽储存,以避免液相污染),大大减少代谢活动,从而保持细胞健康。然而,必须最小化细胞内冰的形成以防止细胞破裂。最常见的冷冻保护剂二甲基亚砜(DMSO)已经以1 g kg-1 day-1的剂量注射给患者,并且已被证明是安全的。
尽管DMSO使冰的形成最小化,但它对细胞也有毒性。因此,必须采取措施使接触时间和渗透压休克最小化。替代的冷冻保护剂,包括糖,例如海藻糖、聚乙烯吡咯烷酮、甲基纤维素、蔗糖和甘油,但其在维持生存力方面不如DMSO有效。然而,来自蚕的蛋白质水解产物丝胶蛋白作为血清成分的替代品,在促进封装细胞存活和低温贮藏方面显示出有希望的结果。
在将DMSO加入到产品中后,应以受控方式冷冻,以防止不合适的温度梯度使细胞活性损失。通常,在控制速率的冷冻机中使用1-2℃ min-1的速率,尽管可以进行重要的开发工作以优化特定产品或容器的冷冻曲线。一旦CTP(细胞治疗产品)冷冻,它通常储存在液氮中,如果需要,产品可以干燥运输,一般情况下,能够将液氮的低温保持几天,最多两周。
虽然冷冻保存已经使用了多年,但仍然存在稳定后细胞功能的挑战。最长期的例子是CD34 +细胞的低温保存,其开始于胎儿脐带血库,其中细胞长期存储(数十年)以用于将来治疗中的潜在用途。虽然CD34 +细胞已经冷冻保存多年,但许多因素的影响仍有待理解,例如冷冻保存前细胞在DMSO中的时间,以及DMSO加入细胞的具体方式。
此外,许多早期的研究可能是使用含有DMSO的低温介质进行的,通常在每个实验室中进行不同的处理,这增加了可变性并且不能很好地控制。非标准化的低温介质可能含有不可持续的添加剂,如血浆或血清。
经常用于细胞疗法的含有DMSO的冷冻保护剂是CryoStor(BioLife Solutions)。值得注意的是,在这个相对较小的行业中,任何单一来源的试剂供应商都可能被视为供应链风险。由于基因修饰的CD34+细胞目前正处于各种血液学应用(如镰状细胞病和β地中海贫血)的临床试验中,工程细胞的脆弱性必须与冷冻保存相关,以确保有效的产品供应。
然后,解冻过程需要尽可能地减少渗透压冲击。但是,它通常是手动执行的,因此难以控制和标准化。解冻后,细胞很脆弱,必须尽快给药以避免活力丧失。在冷冻伤是一个问题的情况下,如MSCs所建议的,细胞在给药前被解冻和再培养以改善解冻后功能。然而,在理想的临床环境中,细胞在给药前不需要洗涤或进一步处理。
由于低温保存存在许多问题,因此应考虑保存或储存细胞治疗产品的替代方案,如冻干。目前并没有取得多大的成功,但据说Prestige Lyotechnology能在室温下保存细胞,Petaka培养基(Celartia)能在室温下保存两周。另一种可能的补救方法是DMSO-free低温保护剂,如PRIME-XV FreezIS DMSO-free (Irvine Scientific;MSCs市场),特别是针对那些由于DMSO暴露而导致效力降低的细胞类型。
然而,这些冷冻保护剂在细胞回收方面可能不太有效,并且必须针对任何特定的CTP(细胞治疗产品)进行测试。诸如ThawSTAR(BioCision)或VIA freeze(Asymptote)等受控解冻装置的进步是用于标准化解冻过程的小瓶和袋子的自动化系统。随着生物保存技术的可持续性和标准化的增加,认识到CTP(细胞治疗产品)运输和储存方面取得的进步也很重要。所谓的智能托运人(EVO Shipper,BioLife Solutions)拥有各种传感器,能够利用全球定位系统来跟踪产品。
自动液氮冷冻机可快速检索产品(Biostore III,Brooks),确保可追溯性并消除与搜索产品相关的任何意外解冻期。虽然已经出现了针对CTP的新生物保存解决方案,但仍然存在许多关于冷冻保存方法的担忧。
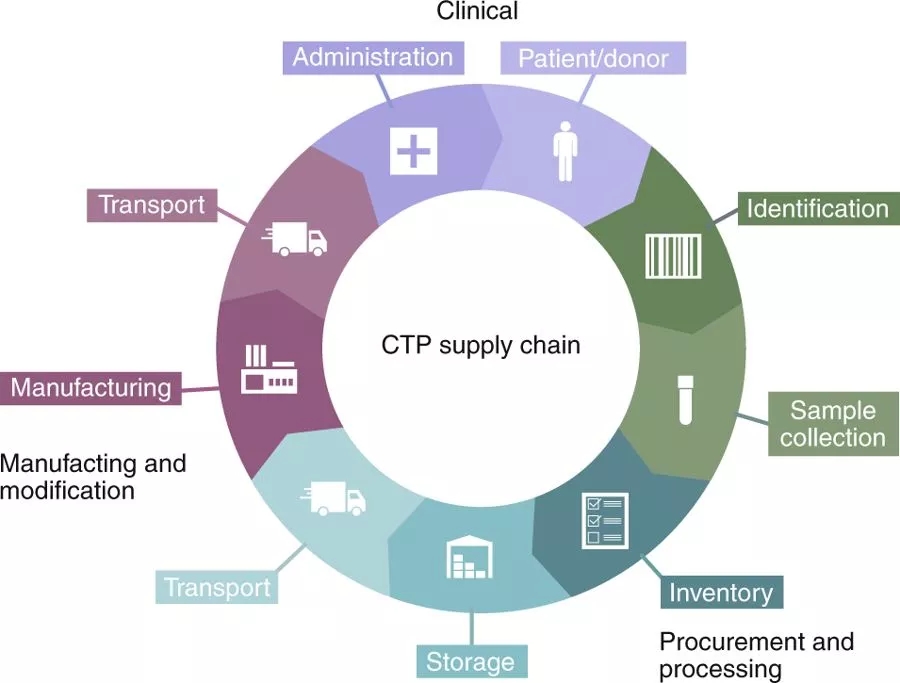
将不断增加的生物保存的CTP(细胞治疗产品)整合到常规临床应用中,提出了新的供应链和后续挑战。虽然不能否认CTP保存对环境和温度控制系统的需求,但有效的分发、处理和链式监护文件对大规模商业化是至关重要的。
对于所有CTPs(细胞治疗产品),质量体系必须记录链式监护,从收集细胞材料开始,然后装运并运输到制造工厂,最后将CTP回输给患者(图6)。CTP的供应链具有挑战性,因为这些过程发生在不同的设施中,并由不同组织的多个人执行和处理。因此,需要一种标准化所需数据的编译和收集的稳健程序。例如,EVO Shipper(BioLife解决方案)包括云服务,该服务集成了热稳定性和精确数据管理,用于端到端保护和患者与制造物流之间CTP的可见性,以及Vineti公司(GE和Mayo Clinic的合资企业)在整个监管链中提供透明度和可见性,简化了从收集和调度到输液的过程;它整合了物流、制造和临床数据,以提高患者安全性和产品性能。
图6:细胞治疗产品CTPs的供应链(图片来源 nature)
展望
2017年,美国首批两种CAR-T细胞产品,分别是Kymriah(诺华)和Yescarta(吉利德)。对于这类和其他有希望的即将到来的细胞疗法,生物制造工程将在产品质量和成本方面产生重大影响。
可扩展性,希望广泛(商业)传播和随后的规模经济使治疗价格适中,即使是对于在人类中进行概念验证测试的早期疗法,也应予以考虑。销售商品的成本正变得越来越明显,尤其是在新的审批项目设定的初始价格区间从9.3万美元到66.5万美元不等。
随着越来越多的商业化产品投放市场,报销机构开始描绘成本与价值的关系。在定价方面,该行业仍然不成熟。而降低销售成本通常需要提高现有的生物制造效率,并且只有在治疗接近关键临床研究时才会大力强调。
标准方法包括将制造过程解构为单元操作,然后根据三组参数分析每个单元操作:输入材料、人工,设备管理费用和时间(图7)。在使用低效生物过程的早期制造阶段,例如PSC分化,成本的主要组成部分在于劳动力和设备管理费用。在后期阶段,通过使用自动化处理平台和定义工序公差,可以显着降低销售成本。通过降低商品成本来推动现有技术的线性扩展以满足目标产品概况的商业组件。虽然生物工程的创新可能会产生新的知识产权障碍,但这些障碍也可能通过提供具有竞争力的成本/处理方程式,显着的影响其适用性。
图7:细胞疗法转化到临床上的分段成本(图片来源 nature)
许多现有的方法在临床测试中的适应性非常好,但最终会在临床试验后的病人负荷的重压下屈服。对于成功的制造,需要考虑四个关键因素:质量、销售成本、可扩展性和可持续性。这四个参数应该被用于细胞治疗的开发过程中,以减轻与扩大规模过程相关的问题。而自动化流程可以放大生物加工工具开发所带来的收益,以达到可扩展性和持续性,最大限度地降低成本和出错的可能性。