首款国产BTK抑制剂获批在即
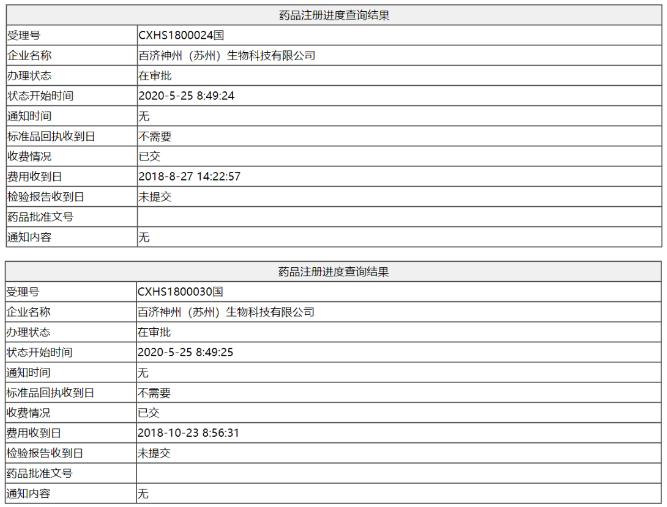
今日(5月26日),据国家药监局官网信息显示,百济神州BTK抑制剂泽布替尼(zanubrutinib)的办理状态有了更新,受理号分别为CXHS1800024、CXHS1800030的受理状态均更新为“在审批”,该两个受理号的适应症分别为复发/难治性套细胞淋巴瘤(R/R MCL)、复发性难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL),这也意味着泽布替尼的该两大适应症获批在即(商品名为百悦泽),一旦获批,泽布替尼也将成为国内上市的首个国产BTK抑制剂。
泽布替尼是一款口服BTK小分子抑制剂,BTK是B细胞受体信号通路的关键组成部分,是各种淋巴瘤(主要是NHL)中细胞增殖和细胞存活的重要调节剂,BTK抑制剂阻断B细胞受体(BCR)诱导BTK活化及其下游信号通路,可成功阻断BTK激活会导致B细胞生长抑制和细胞死亡。
2019年11月,泽布替尼在美国获批用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者此,这是截止目前唯一一款获得FDA批准的在外周血细胞中的占有率达到100%的BTK抑制剂,也是唯一一款每天可服用一次或两次的BTK抑制剂,同时,泽布替尼还成为了迄今为止第一款完全由中国企业自主研发、在FDA获准上市的抗癌新药,实现了中国原研抗癌新药出海“零的突破”。随后,泽布替尼作为二线治疗 MCL 的优先推荐方案,被纳入最新版美国国家综合癌症网络(NCCN)指南。
根据百济神州5月12日公布的2020年第一季度业绩显示,泽布替尼在美国的产品收入为72万美元(在美国的定价为30天的疗程花费为12935美元,约合人民币92284元),财报中,百济神州还披露,除了将在中国获批用于治疗R/R MCL患者以及R/R CLL或SLL患者外,还将最早于2020年下半年公布泽布替尼对比苯达莫司汀联合利妥昔单抗用于治疗初治CLL或SLL患者的SEQUOIA临床试验的主要数据;于2020年在中国递交用于治疗华氏巨球蛋白血症患者(WM)患者的sNDA;于2020年与美国FDA和欧洲EMA讨论泽布替尼对比伊布替尼用于治疗WM患者的ASPEN 3期临床试验(clinicaltrials.gov登记号:NCT03053440)数据;于2020年完成泽布替尼对比伊布替尼用于治疗R/R CLL或SLL患者的3期临床试验(ALPINE ,clinicaltrials.gov登记号:NCT03734016)扩展后的患者入组。
另值得一提的是,泽布替尼日前被纳入2020 版《中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南》,自此,泽布替尼成为了国内首个得到中美临床诊疗指南双重推荐的本土研发抗癌新药。
泽布替尼的未来发展形势看似一片大好,不过,其面临的竞争对手也不容小觑。
截止目前,在肿瘤治疗领域,全球已上市4款BTK抑制剂,除了泽布替尼,还包括强生和艾伯维共同开发的一代BTK抑制剂伊布替尼 (ibrutinib,2013年11月获FDA批准,2017年8月获NMPA批准)、阿斯利康的二代BTK抑制剂阿卡替尼(acalabrutinib,2013年11月获FDA批准),日本小野制药的BTK抑制剂Velexbru(通用名:盐酸tirabrutinib片剂,于今年3月份在日本获批)。同时,在中国市场进展较快还有诺诚健华的奥布替尼,其用于CLL/SLL的上市申请于2019年11月获国家药监局受理,并于今年1月纳入优先审评,于3月份申报的用于MCL的上市申请也已获得受理。
其中,伊布替尼是目前中国市场唯一获批的BTK抑制剂,并于2018年以降幅超65%的价格(189元/粒)进入国家医保目录,在最新的2019全球畅销药物排行榜中,伊布替尼以80.8亿美元位于第五位,在中国市场,有统计数据显示,伊布替尼在2019年Q1样本医院销售额为1877万元,预计2019年样本医院销售额将突破1亿元。
除了肿瘤外,BTK抑制剂还有可能用于治疗包括系统性红斑狼疮(SLE)、类风湿关节炎(RA)、多发性硬化症(MS)在内的多种自身免疫性疾病,现阶段,全球尚无用于治疗前述免疫性疾病的BTK抑制剂获批上市,诺诚健华、罗氏、默沙东、恒瑞医药均有在此布局。
在市场容量方面,根据弗若斯特沙利文分析,BTK抑制剂的全球销售额在2018年达到45亿美元,依据23.3%的复合增长率,这一市场在2023年将预计达到129亿美元,在2030年则达到235亿美元。
对应的中国市场,BTK抑制剂的市场规模预测将达到26亿美元,2018年-2023年的年复合增长率高达89.2%。
有投资机构预测,泽布替尼未来的销售额有望达到8.36亿美元,约合人民币58.58亿元,针对套细胞淋巴瘤的药物销售额将达到9000万美元,约合人民币6.31亿元。